Як отримати
Отримання розглянутих речовин в промисловості має багато способів.
Розглянемо деякі з них:
- Виділення з природних матеріалів — жирів, масел і воску.
- Окислення насичених вуглеводнів. Происходит при підвищеній температурі, наприклад: 2СН 4 + 3О2 → 2 + 22.
- Окислення вуглеводнів з подвійним зв’язком, наприклад = + О2 — СН3СОО.
- Бензойну можна отримати таким шляхом: 565-CH3 + 6КМпО4 + 9H2SO4 → 5C6H5— + 3К2ЅО4 + 6МпЅО4 + 14H2O.
- Мурашину можна синтезувати з допомогою таких реакцій: CO + NаOH → НCOON і HCООNа + H2SO4 → HCOOH + .
В умовах лабораторії розглянуті з’єднання можна отримати за допомогою таких реакцій:
- Застосування солей: R – COONa + HCl → R – COOH + NaCl.
- Розчинення відповідних ангідридів у воді: (R – CO)2 O + H2O → 2 R – COOH. Так можна отримати, наприклад, карбонову кислоту С2Н5ССОН.
- Окислення альдегідів: R – COH + [O] → R – COOH.
- Окислення спиртів: R – CH2 – OH + 2[O] → R – COOH + H2O.
- З застосуванням ціаніду: СН3 – Вг + Na – C≡N → CH3 – CN + NaВr .
У всіх випадках символ R означає будь-вуглеводневий радикал.
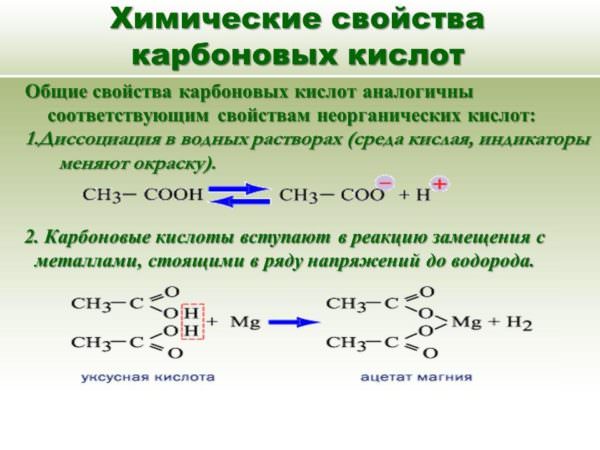
Хімічні властивості карбонових кислот








