Дмитро Менделєєв зміг створити унікальну таблицю хімічних елементів, головним достоїнством якої була періодичність. Метали та неметали в таблиці Менделєєва розміщуються так, що їхні властивості змінюються періодичним чином.
Періодична таблиця Менделєєва

Періодична система була складена Дмитром Менделєєвим у другій половині 19 століття. Відкриття не тільки дозволило спростити роботу хіміків, вона змогла об’єднати в собі як в єдиній системі всі відкриті хімічні речовини, а також передбачити майбутні відкриття.
Створення даної структурованої системи безцінний для науки і для людства в цілому. Саме це відкриття дало поштовх розвитку всієї хімії на довгі роки.
Цікаво знати! Існує легенда, що готова система привиділася вченому уві сні.
В інтерв’ю одному журналісту вчений пояснив, що працював над нею 25 років і те, що вона йому снилася – цілком природно, але це не означає, що уві сні прийшли всі відповіді.
Створена Менделєєвим система поділяється на дві частини:
- періоди – стовпчики по горизонталі в одну або два рядки (лави);
- групи – вертикальні рядки, в один ряд.
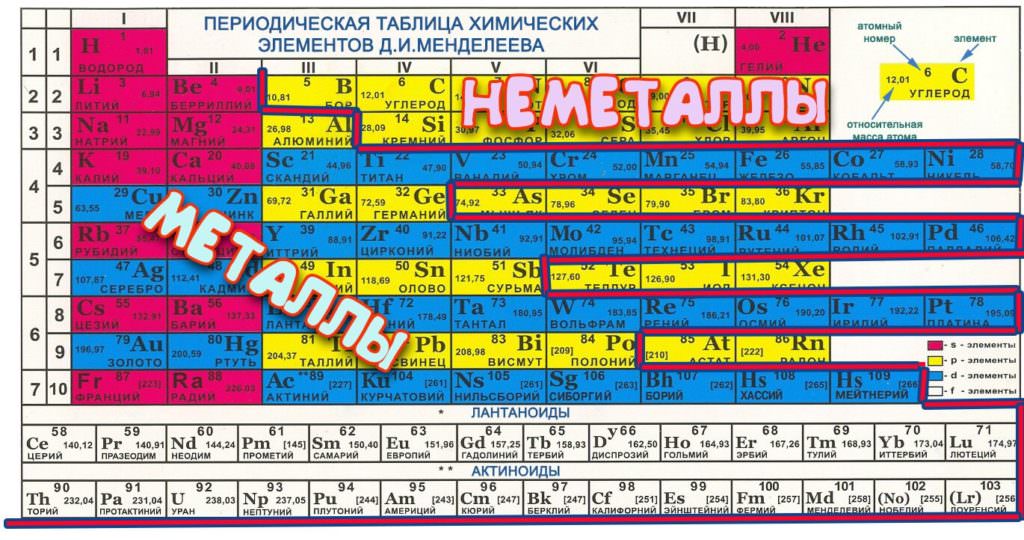
Всього в системі 7 періодів, кожен наступний елемент відмінний від попереднього великою кількістю електронів у ядрі, тобто заряд ядра кожного правого показника більше лівого на одиницю. Кожний період починається з металу, а закінчується інертним газом – саме це і є періодичність таблиці, адже властивості сполук змінюються в межах одного періоду і повторюються в наступному. При цьому, слід пам’ятати, що 1-3 періоди неповні або малі, у них всього 2, 8 та 8 представників. У повному періоді (тобто решти чотирьох) по 18 хімічних представників.

У групі розташовуються хімічні сполуки з однаковою вищою валентністю, тобто у них однакове електронна будова. Всього в системі представлено 18 груп (повна версія), кожна з яких починається лугом і закінчується інертним газом. Всі, представлені в системі субстанції, можна розділити на дві основні групи – метал або металоїд.
Для полегшення пошуку групи мають свою назву, а металеві властивості субстанцій посилюються з кожної нижньої рядком, тобто чим нижче з’єднання, тим більше у нього буде атомних орбіт і тим слабше електронні зв’язку. Також змінюється і кристалічна решітка – вона стає яскраво вираженої у елементів з великою кількістю атомних орбіт.
У хімії використовують три види таблиць:
- Коротка – актиноиды і лантаноиды винесені за межі основного поля, а 4 і всі наступні періоди займають за 2 рядки.
- Довга – в ній актиноиды і лантаноиды винесені за кордон основного поля.
- Сверхдлинная – кожен період займає рівно 1 рядок.
Головною вважається та таблиця Менделєєва, яка була прийнята і підтверджена офіційно, але для зручності частіше використовують коротку версію. Метали та неметали в таблиці Менделєєва розміщуються згідно строгим правилам, які полегшують роботу з нею.








