Полярність
Важливо! Як визначити, речовини з неполярного ковалентного чи полярної зв’язком перед нами? Це дуже просто: перша завжди виникає між однаковими атомами, а друга — між різними, мають неоднакову электроотрицательность.
Приклади ковалентного неполярного зв’язку — прості речовини:
- водень Н2;
- азот N2;
- кисень О2;
- хлор Cl2.
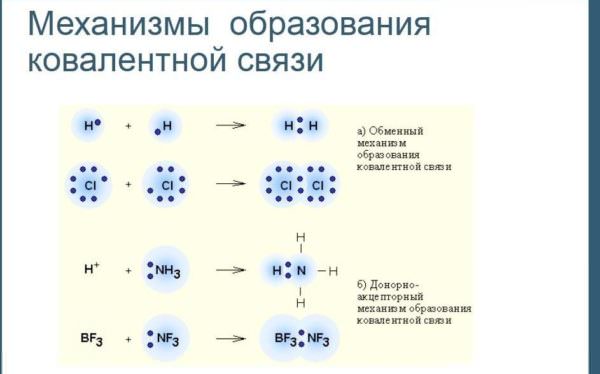
Схема утворення ковалентного неполярного зв’язку показує, що з допомогою об’єднання електронної пари атоми прагнуть доповнити зовнішню оболонку до 8 або 2 електронів. Наприклад, фтору не вистачає одного електрона до восьмиэлектронной оболонки. Після утворення поділеної електронної пари вона заповниться. Поширена формула речовини з ковалентного неполярного зв’язком — двухатомная молекула.

Полярно зазвичай зв’язуються тільки елементи-неметали:
- Hcl;
- Н2О;
- HF;
- CH4.
Але бувають і винятки, такі як AlCl3. Алюміній володіє властивістю амфотерності, тобто в одних з’єднаннях він веде себе як метал, а в інших — як металоїд. Різниця електронегативності в цьому з’єднанні невелика, тому алюміній з’єднується з хлором саме так, а не за іонним типом.
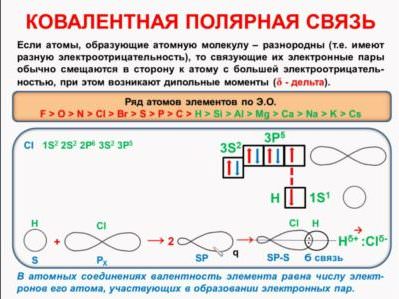
В цьому випадку молекулу утворюють різні елементи, але різниця електронегативності не так велика, щоб електрон повністю перейшов від одного атома до іншого, як в речовинах іонного будови.
Схеми утворення ковалентного структури цього типу показують, що електронна щільність зміщується до більш электроотрицательному атому, тобто поділена електронна пара знаходиться на одному з них ближче, ніж до другого. Частини молекули набувають заряд, який позначається грецькою буквою дельта. У хлороводороде, наприклад, хлор стає заряджений більш негативно, а водень — більш позитивно. Заряд буде частковий, а не цілий, як у іонів.
Важливо! Не слід плутати полярність зв’язку і полярність молекули. У метані СН4, наприклад, атоми пов’язані полярно, а сама неполярна молекула.