Речовини молекулярної будови утворюються з допомогою особливого виду взаємозв’язку. Ковалентний зв’язок в молекулі, полярний і неполярний, також називається атомною. Ця назва походить від латинського «co» — «спільно» і «vales» — «який має силу». При такому способі утворення сполук пара електронів ділиться між двома атомами.
Властивості
Що таке ковалентний полярний і неполярний зв’язок? Якщо нове з’єднання утворюється таким чином, відбувається усуспільнення електронних пар. Зазвичай такі речовини мають молекулярну будову: Н2, О3, HCl, HF, CH4.
Є і немолекулярные речовини, в яких атоми зв’язані таким чином. Це так звані атомні кристали: алмаз, діоксид кремнію, карбід кремнію. В них кожна частинка пов’язана з чотирма іншими, в результаті виходить дуже міцний кристал. Кристали з молекулярною структурою зазвичай не відрізняються високою міцністю.
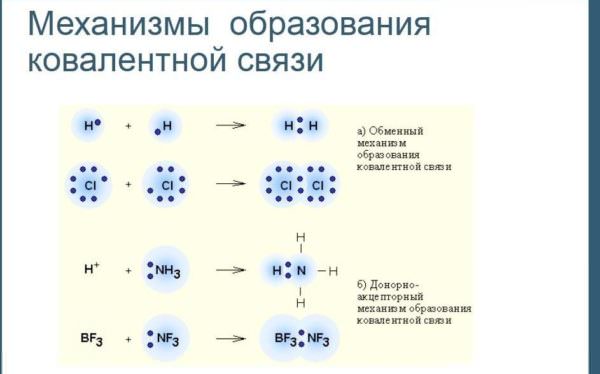
Властивості такого способу утворення сполук:
- кратність;
- спрямованість;
- ступінь полярності;
- поляризовність;
- пару.
Кратність — це кількість неподілених електронних пар. Їх може бути від однієї до трьох. У кисню до заповнення оболонки двох електронів не вистачає, тому вона буде подвійною. У азоту в молекулі N2 вона потрійна.
Поляризовність — можливість утворення ковалентного полярного зв’язку і неполярний. При цьому вона може бути більш або менш полярна, ближче до іонної або навпаки — в цьому полягає властивість ступеня полярності.
Спрямованість означає, що атоми прагнуть з’єднатися таким чином, щоб між ними залишилася як можна велика електронна щільність. Про спрямованості має сенс говорити тоді, коли з’єднуються p або d-орбіталі. S-орбіталі сферично симетричні, для них всі напрямки рівноцінні. У p-орбіталей неполярний або полярний ковалентний зв’язок спрямована уздовж його осі, так що дві «вісімки» перекриваються вершинами. Це σ-зв’язок. Існують і менш міцні π-зв’язку. У випадку p-орбіталей «вісімки» перекриваються бічними сторонами поза осі молекули. У подвійному або потрійному випадку p-орбіталі утворюють одну σ-зв’язок, а інші будуть типу π.
Спряження — це чергування простих і кратних, робить молекулу більш стабільною. Така властивість характерна для складних органічних сполук.

Види і способи утворення хімічних зв’язків








