Корисне відео: полярний і неполярний ковалентний зв’язок
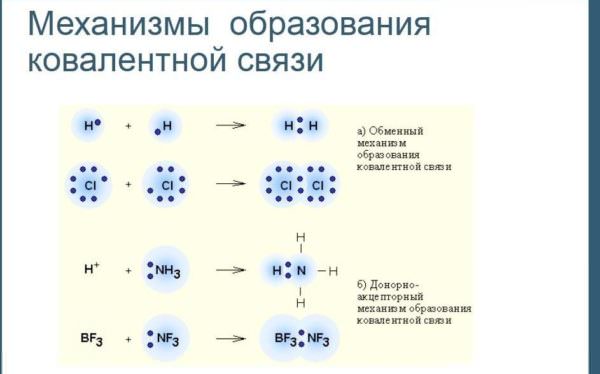
Механізм утворення
Утворення нових речовин може проходити за обмінним або донорно-акцепторної механізму. При цьому об’єднуються атомні орбіталі. Виникає одна або декілька молекулярних орбіталей. Вони відрізняються тим, що охоплюють обидва атома. Як і на атомній, на ній може перебувати не більше двох електронів, причому їх спини теж повинні бути різноспрямованими.
Як визначити, який механізм задіяний? Це можна зробити по числу електронів на зовнішніх орбіталях.
Обмінний
В цьому випадку електронна пара на молекулярної орбіталі утворюється з двох неспарених електронів, кожен з яких належить своєму атому. Кожен з них прагне заповнити свою зовнішню електронну оболонку, зробити її стійкою восьми – або двоелектронного. Так зазвичай утворюються речовини з неполярною структурою.
Для прикладу розглянемо соляну кислоту HCl. У водню на зовнішньому рівні один електрон. У хлору — сім. Намалювавши схеми утворення ковалентного структури для нього, побачимо, що для заповнення зовнішньої оболонки кожному з них не вистачає по одному електрону. Поділивши між собою електронну пару, вони зможуть завершити зовнішню оболонку. За таким же принципом утворюються і двохатомні молекули простих речовин, наприклад, водню, кисню, хлору, азоту та інших неметалів.
Механізм утворення
Донорно-акцепторний
У другому випадку обидва електрона являють собою неподеленную пару і належать одному атому (донора). У іншого (акцептора) є вільна орбіталь.
Формула речовини з ковалентного полярного зв’язком, утвореної таким чином, наприклад, іон амонію NH4+. Він утворюється з іона водню, в якому є вільна орбіталь, і аміаку NH3, що містить один «зайвий» електрон”. Електронна пара з аміаку обобществляется.
Гібридизація
Коли електронна пара обобществляется між орбіталей різної форми, наприклад, s і р, утвориться гібридна електронне хмара sp. Такі орбіталі сильніше перекриваються, тому зв’язуються міцніше.
Так влаштовані молекули метану й аміаку. В молекулі метану СН4 повинні були утворитися три зв’язку з p-орбиталям і одна з s. Замість цього орбіталь гибридизируется з трьох р-орбіталей, виходять три гібридні sp3-орбіталі у формі витягнутих крапель. Це відбувається тому, що електрони 2s і 2p мають близьку енергію, вони взаємодіють один з одним при з’єднанні з іншим атомом. Тоді можна утворити гібридну орбіталь. Отримана молекула має форму тетраедра, водень розташовується в його вершинах.
Інші приклади речовин з гібридизацією:
- ацетилен;
- бензол;
- алмаз;
- вода.
Для вуглецю характерна ѕрЗ-гібридизація, тому вона часто зустрічається в органічних сполуках.