
У хімії є дуже захоплюючий, але складний розділ – електронна конфігурація атомів і іонів.
Молекулу будь-якого з елементів таблиці Менделєєва можна вивчити з точки зору фізики і хімії.
Чудовий молекулярний світ на атомному рівні відрізняється від звичного. Розберемо докладно, як утворюється електронна формула елементів.
Будова «електронних» оболонок атомів
Для кращого розуміння електронних оточуючих ядро оболонок, потрібно знати про іоні – частинці, в основі якої, крім електронів, присутні так звані протони.

Якщо число протонів більше числа електронів, то такий атом називається катіоном (позитивний заряд). В іншому випадку атом називається аніоном (заряд негативний).
Кожен з електронів займає свій власний рівень щодо ядра.
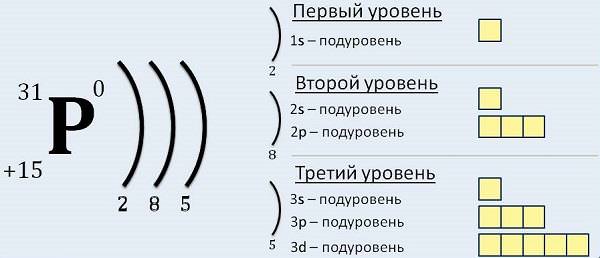
Конфігурація електронів для окремо взятого атома може будуватися в порядку атомних чисел. В якості початкового елемента вибирається водень, а далі триває додавання одного протона до ядра згідно з подсхемой і місцем у періодичній таблиці, поки не опишутся всі хімічні елементи.
Така процедура називається принципом Aufbau (Ауфбау). Назва принципу походить від німецького слова і перекладається «побудувати».
Можна зробити висновок, що поява іонів пов’язано з моментом, коли атоми набувають або втрачають заряди. Катіон (позитивно заряджений іон) утворюється, коли один або кілька зарядів видаляються з «батьківського атома».








