
Вуглець – це, напевно, один з найбільш вражаючих елементів хімії на нашій планеті, який володіє унікальною здатністю утворювати безліч різних органічних і неорганічних зв’язків.
Одним словом, вуглецеві сполуки, які володіють унікальними характеристиками – основа життя на нашій планеті.
Що таке вуглець

У хімічній таблиці Менделєєва Д. І. вуглець знаходиться під шостим номером, входить в 14 групу і носить позначення «З».
Фізичні властивості
Це водневе з’єднання, що входить в групу біологічних молекул, молярна маса і молекулярна маса якого – 12,011, температура плавлення становить 3550 градусів.
Ступінь окислювання даного елемента може бути: +4, +3, +2, +1, 0, -1, -2, -3, -4, а щільність становить 2,25 г/см3.
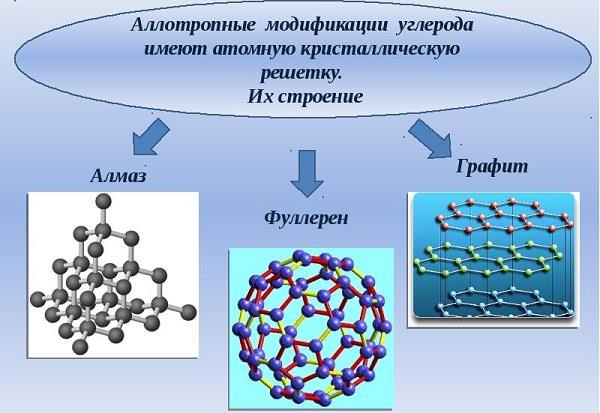
В агрегатному стані вуглець — тверда речовина, а кристалічна решітка — атомна.
Вуглець має наступні алотропні модифікації:
- алмаз;
- графіт;
- фулерен;
- карбін.








