Будова атома
Атом речовини має електронну конфігурацію виду — 1S22S22P2. На зовнішньому рівні у атома 4 електрони, що знаходяться на різних осях.
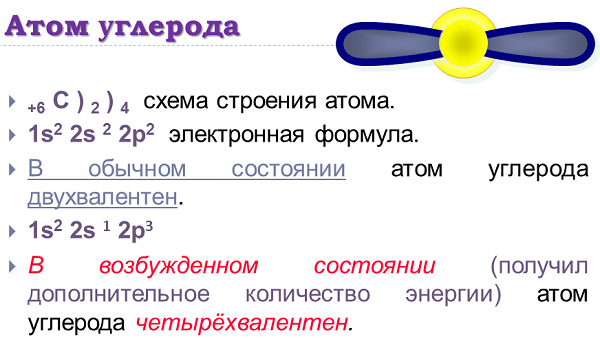
Якщо ж брати збуджений стан елемента, то його конфігурація стає 1S22S12P3.
До того ж атом речовини може бути первинним, вторинним і третинним четвертинним.
Хімічні властивості

Перебуваючи в нормальних умовах, інертний елемент і взаємодія з металами та неметалами набуває при підвищених температурах:
- взаємодіє з металами, внаслідок чого утворюються карбіди;
- вступає в реакцію з фтором (галоген);
- при підвищених температурах взаємодіє з воднем і сіркою;
- при підвищенні температури забезпечує відновлення металів і неметалів з оксидів;
- при 1000 градусів вступає у взаємодію з водою;
- при підвищенні температури горить.
Отримання вуглецю
Вуглець в природі можна знайти у вигляді чорного графіту або ж, що дуже рідко, у вигляді алмазу. Ненатуральний графіт одержують з допомогою реакції коксу з кремнеземом.

А натуральні алмази отримують, застосовуючи тепло і тиск разом з каталізаторами. Так метал розплавляється, а отриманий алмаз виходить у вигляді осаду.

Додавання азоту призводить до отримання жовтуватих алмазів, а бору – блакитних.








