
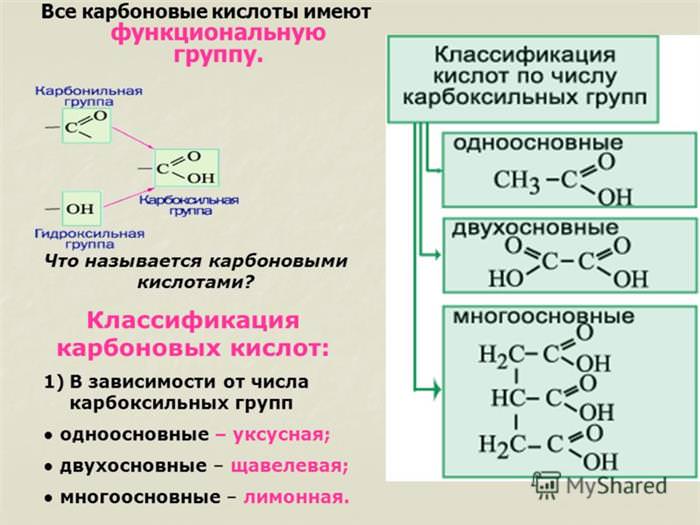
Органічні сполуки, звані карбоновими кислотами, — клас органічних сполук, у складі молекул яких містяться карбоксильні групи, -COOH, одна або декілька. Легке відщеплення протону карбоксильної групи обумовлює кислі властивості таких сполук.
Номенклатура і будова органічних сполук
Назва номенклатурою ІЮПАК будується з назви вуглеводню, відповідного вуглецевої ланцюгом, що містить функціональну групу, з закінченням «овая» і додаванням слова «кислота». Атом вуглецю в складі карбоксильної групи вважається першим у вуглеводневій ланцюжку. Наприклад, для формули СН3-СН2-COOH назва речовини — пропановий кислота, а СН3-С(СН3)-СООН — 2-метилпропановая, CH3CH2CH2COOH — бутанова.
Раціональна номенклатура до назви вуглеводню вимагає додавання закінчення «карбонова» і слова «кислота», причому атом вуглецю карбоксила в нумерацію не включається. Наприклад, этилкарбоновая кислота — СН3-СН2-СООН.
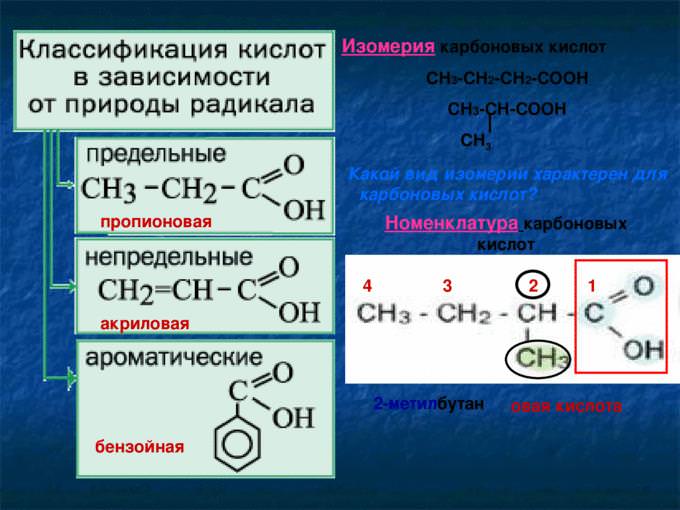
У багатьох речовин гомологічного ряду кислот є тривіальні назви. Наприклад, оцтова (СН3СООН), мурашина (НСООН), валеріанова (С4Н8-СООН), маргаринова (С16Н33-СООН) та багато інших.
Функціональна група COOH складається з карбонила — CO і гідроксилу — OH, тим не менш властивості кислот відрізняються від властивостей альдегідів і спиртів, що містять у своєму складі ці групи.
Загальна формула насичених одноосновних карбонових кислот^ R-COOH, де R — вуглеводневий радикал.
Класифікація карбонових кислот
Молекули, що містять одну функціональну групу, будуть називатися одноосновних (монокарбоновыми), що містять дві і більше — ді – і багатоосновними (відповідно ді – і поликарбоновыми).
В залежності від того, з яким радикалом пов’язаний карбоксил, кислоти поділяють на такі:
- ареновые;
- аліфатичні;
- алициклические;
- гетероциклічні.
По насиченості вуглеводневого радикалу поділяють насичені (граничні, алканових) і ненасичені (ненасичені).
При інших функціональних групах кислоти будуть називатися гетерофункциональными, наприклад, амінокислоти, нитрокислоты і т. д.
Якісні реакції
Основні якісні реакції органічної хімії:
- забарвлення індикатора — червоне фарбування лакмус;
- реакція з карбонатами або гидрокарбонатами, наприклад, з содою — виділення СО2;
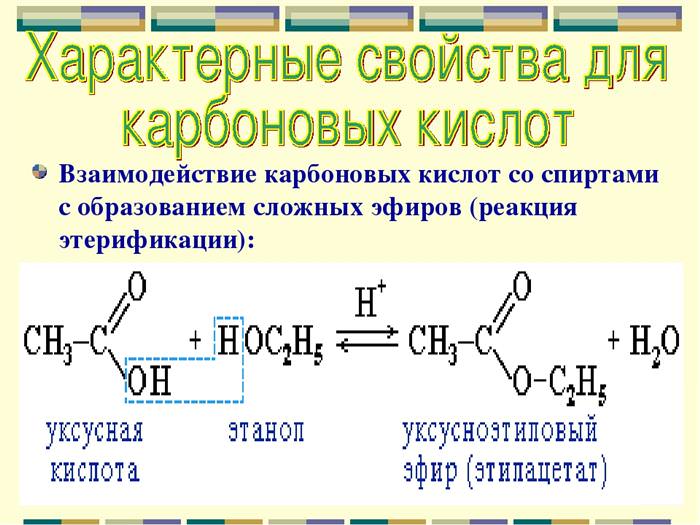
- реакція етерифікації — характерний запах продукту реакції (ефіру).
Фізичні властивості
Зі збільшенням маси молекули зменшується щільність і розчинність у воді, температура кипіння ж, навпаки, збільшується. Так, нижчі, наприклад, оцтова і мурашина кислоти є розчинними у воді рідинами, а вищі карбонові кислоти, такі як пеларгоновая, стеаринова, пальмітинова та інші — тверді речовини, які у воді не розчиняються.
Молекули монокарбонових кислот утворюють досить міцні водневі зв’язки. У твердому і рідкому станах вони знаходяться у вигляді циклічних димерів, а у водних розчинах — у вигляді лінійних.
Цікава закономірність спостерігається у зміні температур плавлення кислот нормальної будови. Кислоти, кількість атомів вуглецю в радикалі, яких парна, киплять при більш високих температурах, ніж мають непарне. Пояснюється це симетричність будови молекул з парною кількістю вуглецевих атомів і, як наслідок, більш сильним взаємодією між молекулами, а значить більшої міцністю кристалічної решітки речовини. Молекули ж непарного ряду взаємодіють слабкіше, відповідно, зруйнувати їх взаємодія при нагріванні простіше.
Хімічні властивості
Таблиця основних властивостей карбонових кислот.
| Кислотні властивості | |
| Характерні кислотні властивості виявляються в реакціях з металами, гідроксидами та основними оксидами, а також при витісненні кислоти (слабшої) з солі. | 2CH3COOH + Mg ⟶ (CH3COO)2Mg + H2 ch 3 cooh + koh ⟶ CH3COO ДО + H2O ch 3 cooh + NH4OH ⟶ CH3COONH4 + H2O 2CH3COOH + CaO ⟶ (CH3COO)2C a + H2O 2CH3COOH + Na2SiO3 ⟶ H2SiO3 + 2CH3COONa |
| Дисоціація | |
| У водних розчинах поведінка монокарбонових аналогічно поведінці одноосновних: відбувається іонізація молекули з утворенням іона водню і карбоксилат іона. | RCOOH ⟶ RCOO — + Н+ |
| Відновлення | |
| Відновлення до спирту відбувається за допомогою литийалюминийгидрида ( LiAlH4), а також при кип’ятінні в тетрагідрофурані. Плюсом відновлення в диборане (B2H4) є те, що процес йде в більш м’яких умовах і відновлення інших функціональних груп не відбувається (NO2, COOR і СN). | CH3(CH2)4COOH + H2 → CH3(CH2)4CH2OH + H2O |
| Окислення | |
| В атмосфері кисню відбувається окислення з виділенням вуглекислого газу і води. | CH 3 COOH + 2 O 2 ⟶ 2СО2 + 2H2O |
| Декарбоксилювання | |
Насичені одноосновные ограніческіе з’єднання складно піддається декарбоксилюванню навіть при нагріванні з-за міцності зв’язку вуглець-вуглець:
|
|
| Реакція етерифікації | |
| Нагрівання в присутності H2SO4 спирту і карбонової кислоти призводить до складних ефірів | CH 3 COOH + CH3CH2OH ⟶ CH3COOCH2CH3 + H2O |
| Утворення похідних | |
Заміщення гідроксильної групи іншою функціональною групою (Х) приводить до утворення речовин з загальною формулою RCO — X . Це можуть бути, наприклад:
|
|
| Отримання ангідридів | |
| Похідні загальною формулою R-C(O)-O-C(O)-R отримують міжмолекулярною дегідратацією карбонових органічних сполук. Реакція проходить в присутності водоотнимающего агента (P2O5). | CH 3 COOH + CH 3 COOH ⟶ CH3 -C(O)-O-C(O)- CH3 |
| Галогенирование | |
| Взаємодія з галогенами на світлі призводить до утворення галогензамещенных (α-галогенкарбоновых) кислот. | C2H5COOH + Br2 ⟶ CH3CH(Br)COOH + HBr або ch 3 cooh + 3Cl2 ⟶ C(Cl)3COOH + 3HCl |
Карбонові вважаються слабкими кислотами. При цьому монокарбонові слабкіше ді – і трикарбонових кислот. Заступники, які є донорами електронів, послаблюють кислотні властивості, а электроноакцепторные заступники підсилюють їх, як і кратні зв’язки. Чим далі заступник від карбоксильної групи, тим слабкіше його вплив.
До важливих властивостей таких похідних, як солі відноситься реакція отримання кетонів методом піролізу. Кальцієві, торієві або барієві солі при нагріванні до температури близько 300 °С перетворюються на кетони.
Способи отримання
У лабораторії можна отримати:
-

окисленням: альдегідів R-COH + [O] → R-COOH, спиртів R-CH2-OH + 2[O] → R-COOH + H2O, алкенів;
- деструкцією алкенів;
- гідролізом складних ефірів R-COOR1 + H2O → R-COOH + R1-COOH, галогенопохідних R-COCl + NaOH → 2R-COOH + NaCl, амідів, нітрилів, тригалогеналканов;
- декарбоксилированием;
- з солей R-COONa + HCl → R-COOH + NaCl;
- розчиненням ангідридів (R-CO)2 O + H2O → 2R-COOH.
Промислові способи синтезу ґрунтуються на окисненні вуглеводнів з довгими вуглеводневими ланцюгами. Процес багатоступеневий з безліччю побічних продуктів.
Окиснення алкенів: 2CH3-CH2-CH2-CH3 + 5O2 → 4CH3COOH + 2H2O.
Окиснення алкенів: CH2=CH2 + O2 → СН3СООНСН3-CH=CH2 + 4[O] → ch 3 cooh + HCOOH.
Деякі кислоти (мурашина, масляна, оцтова, валеріанова та інші) виходять специфічними способами з використанням природних інгредієнтів (жирів, ефірних масел, воску).
Застосування карбонових кислот
Застосовують кислоти в хімічній промисловості в якості вихідних сполук для органічного синтезу, наприклад, галогенкислот, кетонів, вінілових ефірів.
Області застосування мурашиної кислоти засновані на її бактерицидних властивостях. Вона застосовується в якості антисептика, в харчовій промисловості, а так само сільському господарстві як консервант.
В харчовій, хімічній, фармацевтичній промисловості, а також у домашньому господарстві активно застосовується оцтова.
Масляна кислота в хімічній промисловості використовується в якості речовини, з якого виробляють ароматизатори, пластифікатори, з її допомогою екстрагують лужно-земельні метали.
Щавлева може застосовуватися в якості реагенту в аналітичній хімії органічних речовин, у металургійній промисловості, для приготування чорнила.
Стеаринова C17H35COOH, пальмітинової C15H31COOH використовуються як компонент косметичних засобів, в якості мастильного матеріалу при обробці металів. Їх натрієва сіль є поверхнево активною речовиною.









