
Свій початок теорія електролітів бере ще в першій половині XIX століття, коли М. Фарадей провів свої знамениті досліди з розчинами кухонної солі. Він встановив, що абсолютно чиста вода дуже погано проводить електричний струм, але варто додати в неї кілька кристалів солі, і провідність тут же зростає. Вже тоді народилося припущення, що сіль розчиняється у воді на якісь частинки, які здатні проводити електричний струм, однак, повноцінна теорія, що описує всі ці процеси в розчинах, з’явилася набагато пізніше.
Теорія електролітичної дисоціації

Теорія, основоположником якої був Сванте Арреніус у період 1883-1887 рр., базується на ідеї, що при попаданні молекул розчинної речовини (не електроліту) в полярну або неполярних рідину відбувається їх дисоціація на іони. Електролітами називаються з’єднання, які в розчині спонтанно розпадаються на іони, здатні до самостійного існування. Кількість утворених іонів, їх будова і величина заряду залежать тільки від природи диссоциировавшей молекули.

Для використання теорії в описі властивостей розчинення використовується ряд припущень, а саме: передбачається, що дисоціація є неповною, іони (їх електронні оболонки) не реагують один з одним, а їх поведінку можна описати законом діючих мас в ідеальних умовах. Якщо розглянути теоретичну систему, де електроліт КА знаходиться в фазовому рівновазі з продуктами свого дисоціації — катіоном К+ і аніоном А-, то згідно закону діючих мас можна скласти рівняння реакції дисоціації:
KA = K+ + A (1)
Константа рівноваги, записана, через концентрації речовин при ізотермічних умовах буде мати таке значення:
Кд = [K+] x [A-] / [KA] (2)
У цьому випадку (рівняння 2), константа рівноваги Кд, буде не чим іншим, як константою дисоціації, значення [KA], [K+], [A] в правій частині — це рівноважні концентрації електроліту і його продуктів дисоціації.
З огляду на допущення теорії Арреніуса, які були застосовані автором, зокрема, про неповноту дисоціації, вводиться поняття ступеня дисоціації — α. Таким чином, якщо висловити концентрацію розчину (моль/л), то на літр розчину доводиться аС моль електроліту (КА), а рівноважна концентрація може бути виражена, як (1-α)моль/л. З рівняння реакції (1) очевидно, що на аС моль електроліту (КА) утворюється така ж кількість іонів К+ і А-. Якщо підставити всі ці величини в рівняння (2) і провести ряд спрощень, то отримаємо формулу константи дисоціації (ступінь дисоціації формула):
Кд = ∝ 2 x /1-∝ (3)

Це рівняння дозволяє кількісно визначити величину ступеня електролітичної дисоціації в різних розчинах.
Теорія Арреніуса дала розвиток безлічі наукових напрямків в хімії: з її допомогою були створені перші теорії кислот і підстав, були надані пояснення фізико-хімічним процесам в гомогенних системах. Тим не менш, вона не позбавлена недоліків, які в основному відносяться до того факту, що теорія не враховує межионные взаємодії.
Класифікація електролітів з прикладами
Електроліти класифікують на слабкі і сильні, періодично виділяючи групу електролітів середньої сили. Сильні електроліти характеризуються тим, що розпадаються у розчині повністю. Як правило — це сильні мінеральні кислоти, наприклад:
- Азотна кислота — HNO3.
- Хлороводородная кислота — HCl.
- Хлорне кислота — HClO4.
- Ортофосфорна кислота — H3PO4.
Сильними електролітами можуть бути підстави, наприклад:
- Гідроксид натрію NaOH.
- Гідроксид калію — KOH.
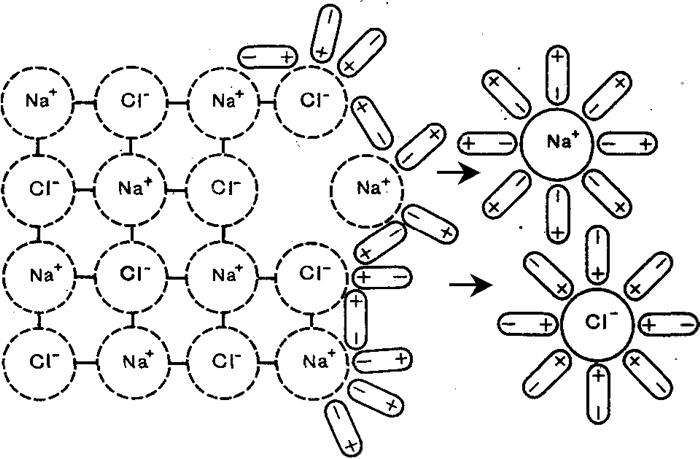
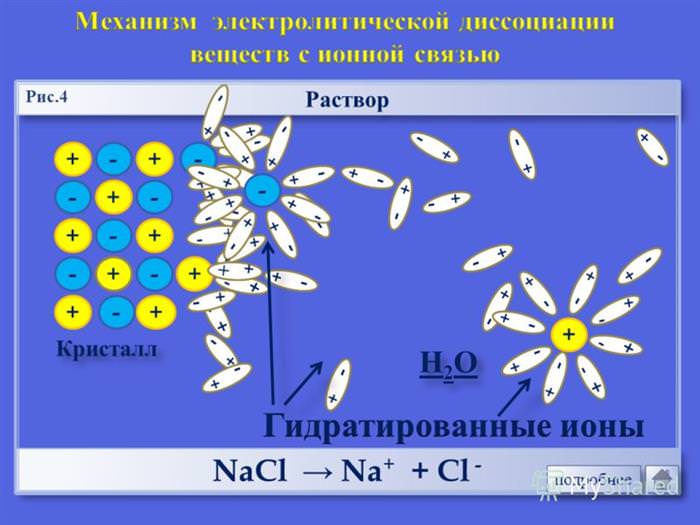
Основна маса сильних електролітів — це переважна більшість солей (NaCl, Na2SO4, Ca (NO3)2, CH3COONa, хлориди, сульфіди).
Слабкі електроліти, навпаки, в розчинах зволожують частково. До цієї групи слід відносити неорганічні кислоти (h 2 co 3, H3BO3, H3AsO4), слабкі основи (амоній), деякі солі (HgCl2), органічні кислоти (ch 3 cooh, C6H5COOH), феноли та аміни. У неводних розчинах одні і ті ж з’єднання можуть бути сильними і слабкими електролітами, таким чином, залежать від природи розчинника.








