Сірка – найважливіший елемент в сучасній промисловості.
Особливі властивості сірки (антисептичні та антипаразитарні) роблять її незамінним компонентному багатьох лікарських препаратів.
Що таке сірка і як вона виглядає
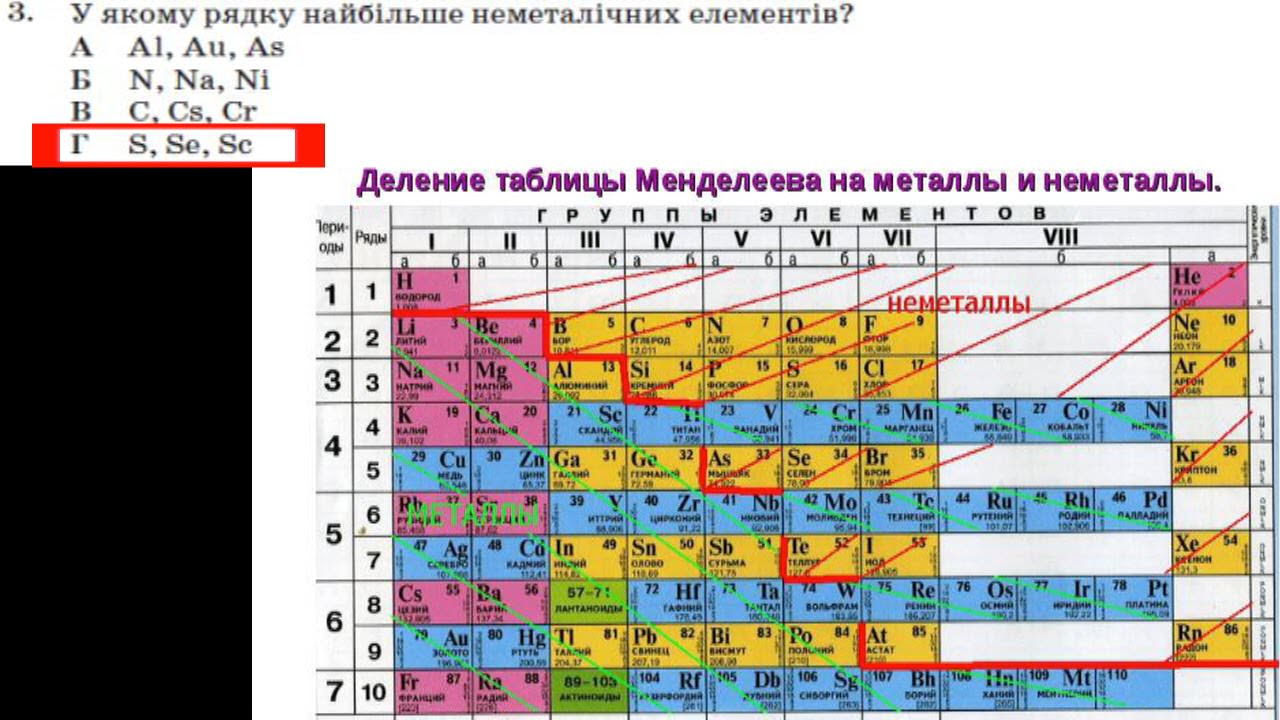
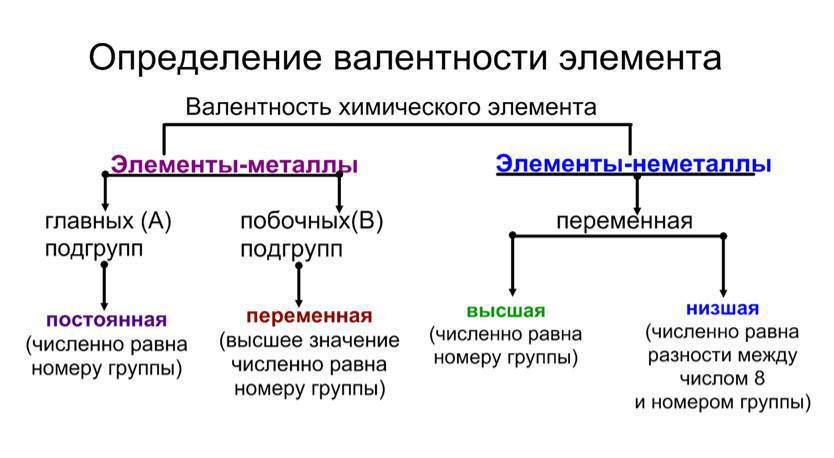
Сірка – хімічний елемент, що знаходиться за 16 номером в таблиці Менделєєва Д. І. і помічається буквою S (по першій літері латинського назви Sulphur).

Молярна маса сірки дорівнює 32, 065 г/моль, атомна маса — 32,066 а. е. м. Ця речовина може бути як яскраво-жовтого, так і коричневого кольору.

Розрізняють порошкоподібну (мелене) і рідку сірку.
Характеристика сірки
Сірка – речовина із змінним ступенем окиснення. На зовнішньої електронної орбіталі сірки розташовані шість валентних електронів, для заповнення не вистачає ще двох, тому в сполуках з металами і воднем вона проявляє валентність -2.
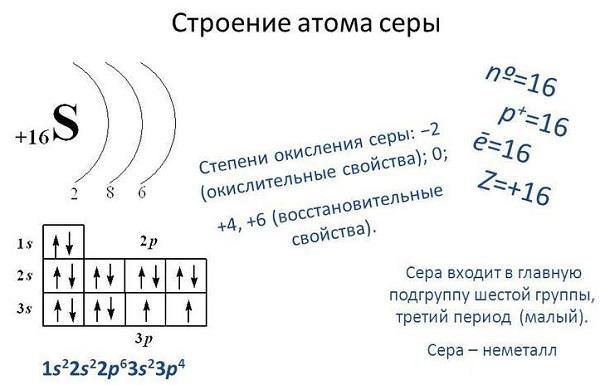
При взаємодії з киснем і галогенами, тобто з елементами з більшою электроотрицательностью, сірка може проявляти позитивну валентність, наприклад, +4 і +6.
Фізичні властивості
Як проста речовина, сірка утворює кілька аллотропних модифікацій:
- Ромбічна – те, що ми звикли називати звичайної сірої. Вона стійка при звичайних умовах, зустрічається найчастіше недалеко від діючих або погаслих вулканів.
- Пластична – являє собою замкнуті або відкриті ланцюжка соединяющейся між собою сірки, одержувані зазвичай при її спалюванні. Має найбільшу молекулярну масу серед всіх різновидів сірки.
- Моноклинная (S8) – сполука сірки, яке в молекулярному вигляді являє собою восьмикутник з атомами сірки в вершинах. Виглядає як безліч циліндрів, схожих на голки. При кімнатній температурі швидко перетворюється на ромбічну.
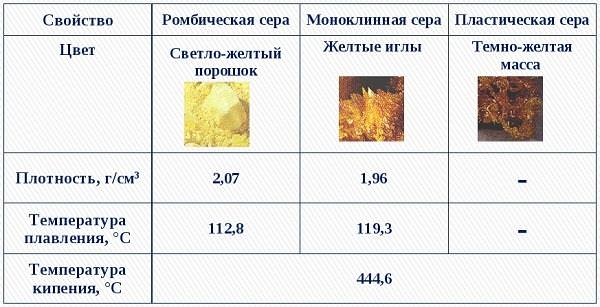
Приблизна молярна маса однієї молекули моноклінної сірки – 256 г/моль. У Росії сірка, в основному, буває лише двох товарних видів: гранульована і комове.
Сірка – легкоплавкое речовина, температура плавлення близько 120 градусів. Нерозчинні у воді і не намокає про зіткненні з нею.
Не має електролітичними властивості і теплопровідність. Щільність сірки — 2,070 г/см3.
Хімічні властивості
В з’єднанні з воднем утворює сірчану (хімічна формула H2SO4) зі ступенем окислення сірки +6 і сірчисту (H2SO3) зі ступенем окислення +4 кислоти, які дають відповідно сульфати та сульфіти.

В нормальних умовах реагують з активними металами і ртуттю, утворюючи сульфіди:
Hg + S = HgS
Na + S = Na 2 S
Також утворює сульфіди при нагріванні з більшістю неактивних металів, крім платини і золота:
Fe + S (t) = Fe2S3
Проявляє відновні властивості в реакції з киснем при нагріванні, утворюючи кислотний оксид:
S + O2 = SO2
У реакціях з воднем утворює сірчаний газ, летка безбарвна речовина з неприємним запахом тухлих яєць:
H2 + S = H2S