Характеристика речовин
Дізнаємося, що таке галогени в хімії. Характеристика списку галогенів наступна:
- будова зовнішнього шару електронів — nS2nP5;
- у міру зростання номера таблиці радіус атома стає більше, электроотрицательность падає, властивості неметалів знижуються;
- є вираженими окислювачами, причому ця здатність елементів знижується по мірі збільшення маси атома (єдине, з чим не реагує галоген, — це благородні гази);
- всі молекули містять 2 атома;
- сила кислот збільшується по мірі зростання відносної маси атома.
Періодична таблиця показує, що чим вище знаходиться елемент, тим сильніше його окислювальні здібності.
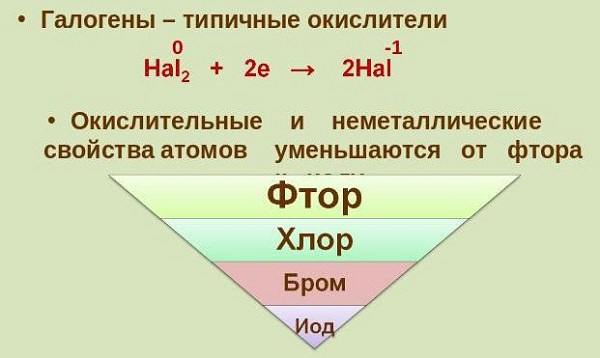
Окислювальні властивості атомів
Фтор
При нормальних умовах є блідо-жовтим газом. Можна отримати шляхом електролізу КНF2. Реагує з водою з утворенням фтороводень і кисню. Реакція водню і фтору відбувається дуже активно. Взаємодіє з металами і неметалами.
Хлористоводнева кислота є слабкою, фтороводород оборотно дисоціюють у воді з виходом іонів Н+ і F-.
Фтороводородная кислота здатна розчинити скло:
SiO2 + 4НF → Sif 4 + 2Н2О.
Хлор
Є газом зеленуватого кольору з задушливим запахом. Приклади реакцій, з допомогою яких можна його отримати:
- МпО2 + 4НCl → МnСl2 + Сl 2+ 2Н2О;
- 2КМпО4 + 16НCl → 2МnСl2 + 5Сl2 + 2КСl + 8Н2О.
Дізнаємося, які хімічні властивості хлору:
- Взаємодія з металами: 2К + Сl 2 → 2КСl.
- Реакція з неметалами: 2Р + 3Сl2 → 2РСlЗ.
- Реакції з лугами: Сl 2 + Са(ОН)2 → CaОCl2 + H2O.
- Витіснення йоду: Cl2 + 2→ 2 + I2.
Список поширених кислот:
- хлорнуватиста кислота HClO (ступінь окиснення хлору +1);
- хлориста кислота HClO2 (ступінь окислення +3);
- хлорноватая кислота HClO3 (ступінь окислення +5);
- хлорне кислота Hclo 4 (ступінь окислення +7).
Бром
Бром являє собою важку темну рідину з поганим запахом. Багатьох цікавить, з чим він реагує. Цей елемент вступає в реакцію з:
- металами: 2Nа + Вг2 → 2NаВr;
- неметалами: Н2 + Вг2 → 2НВг;
- водою: Н2 + H2O → НВг + НВгО;
- відновниками: Вг2 + Н2Ѕ → S + 2НВг.
Бромистий водень добре реагує із солями, основами, оксидами металів.
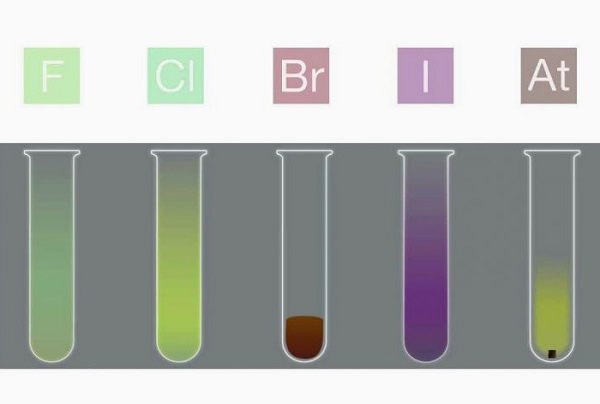
Галогени
Йод
Йод — кристалічна речовина темного фіолетового відтінку. Розчиняється в спирті, четыреххлористом вуглеці. Молекули взаємодіють з:
- металами: ДО + I → KI;
- воднем: H2 + I2 → 2HI;
- підставами: 3I2 + 6КОН → 5КІ + КІО3 + 3H2O.
Йодистоводородная кислота є сильним відновником. При реакції солей з ляпісом утворюється нерозчинна йодисте срібло. Йодна кислота є дуже сильним окислювачем (ступінь окиснення йоду +7).
Що стосується астата, його можна отримати тільки штучним шляхом. Відновлюється з допомогою діоксиду сірки, осідає сірководнем. Реагує з йодом і бромом. Розчиняється слабкою соляної та азотної кислотою.
Фізичні і хімічні властивості елемента теннесин вивчені мало зважаючи малої тривалості його існування ізотопів. Передбачається, що важкі радіоактивні елементи можуть мати відновною активністю.








