Речовини молекулярної будови утворюються з допомогою особливого виду взаємозв’язку. Ковалентний зв’язок в молекулі, полярний і неполярний, також називається атомною. Ця назва походить від латинського «co» — «спільно» і «vales» — «який має силу». При такому способі утворення сполук пара електронів ділиться між двома атомами.
Властивості
Що таке ковалентний полярний і неполярний зв’язок? Якщо нове з’єднання утворюється таким чином, відбувається усуспільнення електронних пар. Зазвичай такі речовини мають молекулярну будову: Н2, О3, HCl, HF, CH4.
Є і немолекулярные речовини, в яких атоми зв’язані таким чином. Це так звані атомні кристали: алмаз, діоксид кремнію, карбід кремнію. В них кожна частинка пов’язана з чотирма іншими, в результаті виходить дуже міцний кристал. Кристали з молекулярною структурою зазвичай не відрізняються високою міцністю.
Властивості такого способу утворення сполук:
- кратність;
- спрямованість;
- ступінь полярності;
- поляризовність;
- пару.
Кратність — це кількість неподілених електронних пар. Їх може бути від однієї до трьох. У кисню до заповнення оболонки двох електронів не вистачає, тому вона буде подвійною. У азоту в молекулі N2 вона потрійна.
Поляризовність — можливість утворення ковалентного полярного зв’язку і неполярний. При цьому вона може бути більш або менш полярна, ближче до іонної або навпаки — в цьому полягає властивість ступеня полярності.
Спрямованість означає, що атоми прагнуть з’єднатися таким чином, щоб між ними залишилася як можна велика електронна щільність. Про спрямованості має сенс говорити тоді, коли з’єднуються p або d-орбіталі. S-орбіталі сферично симетричні, для них всі напрямки рівноцінні. У p-орбіталей неполярний або полярний ковалентний зв’язок спрямована уздовж його осі, так що дві «вісімки» перекриваються вершинами. Це σ-зв’язок. Існують і менш міцні π-зв’язку. У випадку p-орбіталей «вісімки» перекриваються бічними сторонами поза осі молекули. У подвійному або потрійному випадку p-орбіталі утворюють одну σ-зв’язок, а інші будуть типу π.
Спряження — це чергування простих і кратних, робить молекулу більш стабільною. Така властивість характерна для складних органічних сполук.

Види і способи утворення хімічних зв’язків
Полярність
Важливо! Як визначити, речовини з неполярного ковалентного чи полярної зв’язком перед нами? Це дуже просто: перша завжди виникає між однаковими атомами, а друга — між різними, мають неоднакову электроотрицательность.
Приклади ковалентного неполярного зв’язку — прості речовини:
- водень Н2;
- азот N2;
- кисень О2;
- хлор Cl2.
Схема утворення ковалентного неполярного зв’язку показує, що з допомогою об’єднання електронної пари атоми прагнуть доповнити зовнішню оболонку до 8 або 2 електронів. Наприклад, фтору не вистачає одного електрона до восьмиэлектронной оболонки. Після утворення поділеної електронної пари вона заповниться. Поширена формула речовини з ковалентного неполярного зв’язком — двухатомная молекула.

Полярно зазвичай зв’язуються тільки елементи-неметали:
- Hcl;
- Н2О;
- HF;
- CH4.
Але бувають і винятки, такі як AlCl3. Алюміній володіє властивістю амфотерності, тобто в одних з’єднаннях він веде себе як метал, а в інших — як металоїд. Різниця електронегативності в цьому з’єднанні невелика, тому алюміній з’єднується з хлором саме так, а не за іонним типом.
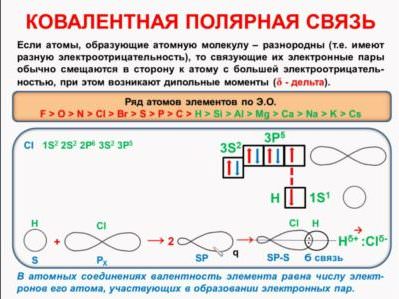
В цьому випадку молекулу утворюють різні елементи, але різниця електронегативності не так велика, щоб електрон повністю перейшов від одного атома до іншого, як в речовинах іонного будови.
Схеми утворення ковалентного структури цього типу показують, що електронна щільність зміщується до більш электроотрицательному атому, тобто поділена електронна пара знаходиться на одному з них ближче, ніж до другого. Частини молекули набувають заряд, який позначається грецькою буквою дельта. У хлороводороде, наприклад, хлор стає заряджений більш негативно, а водень — більш позитивно. Заряд буде частковий, а не цілий, як у іонів.
Важливо! Не слід плутати полярність зв’язку і полярність молекули. У метані СН4, наприклад, атоми пов’язані полярно, а сама неполярна молекула.
Корисне відео: полярний і неполярний ковалентний зв’язок
Механізм утворення
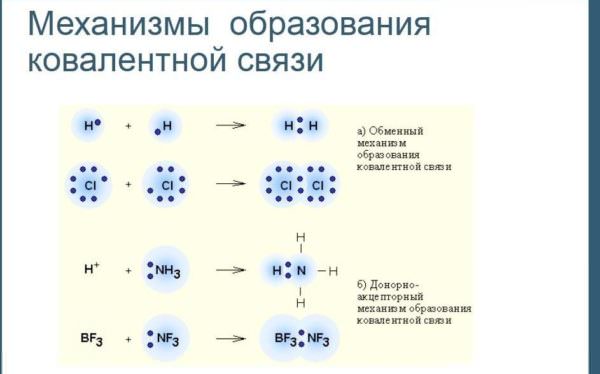
Утворення нових речовин може проходити за обмінним або донорно-акцепторної механізму. При цьому об’єднуються атомні орбіталі. Виникає одна або декілька молекулярних орбіталей. Вони відрізняються тим, що охоплюють обидва атома. Як і на атомній, на ній може перебувати не більше двох електронів, причому їх спини теж повинні бути різноспрямованими.
Як визначити, який механізм задіяний? Це можна зробити по числу електронів на зовнішніх орбіталях.
Обмінний
В цьому випадку електронна пара на молекулярної орбіталі утворюється з двох неспарених електронів, кожен з яких належить своєму атому. Кожен з них прагне заповнити свою зовнішню електронну оболонку, зробити її стійкою восьми – або двоелектронного. Так зазвичай утворюються речовини з неполярною структурою.
Для прикладу розглянемо соляну кислоту HCl. У водню на зовнішньому рівні один електрон. У хлору — сім. Намалювавши схеми утворення ковалентного структури для нього, побачимо, що для заповнення зовнішньої оболонки кожному з них не вистачає по одному електрону. Поділивши між собою електронну пару, вони зможуть завершити зовнішню оболонку. За таким же принципом утворюються і двохатомні молекули простих речовин, наприклад, водню, кисню, хлору, азоту та інших неметалів.
Механізм утворення
Донорно-акцепторний
У другому випадку обидва електрона являють собою неподеленную пару і належать одному атому (донора). У іншого (акцептора) є вільна орбіталь.
Формула речовини з ковалентного полярного зв’язком, утвореної таким чином, наприклад, іон амонію NH4+. Він утворюється з іона водню, в якому є вільна орбіталь, і аміаку NH3, що містить один «зайвий» електрон”. Електронна пара з аміаку обобществляется.
Гібридизація
Коли електронна пара обобществляется між орбіталей різної форми, наприклад, s і р, утвориться гібридна електронне хмара sp. Такі орбіталі сильніше перекриваються, тому зв’язуються міцніше.
Так влаштовані молекули метану й аміаку. В молекулі метану СН4 повинні були утворитися три зв’язку з p-орбиталям і одна з s. Замість цього орбіталь гибридизируется з трьох р-орбіталей, виходять три гібридні sp3-орбіталі у формі витягнутих крапель. Це відбувається тому, що електрони 2s і 2p мають близьку енергію, вони взаємодіють один з одним при з’єднанні з іншим атомом. Тоді можна утворити гібридну орбіталь. Отримана молекула має форму тетраедра, водень розташовується в його вершинах.
Інші приклади речовин з гібридизацією:
- ацетилен;
- бензол;
- алмаз;
- вода.
Для вуглецю характерна ѕрЗ-гібридизація, тому вона часто зустрічається в органічних сполуках.
Корисне відео: ковалентний полярний зв’язок
Висновок
Ковалентний зв’язок, полярний або неполярний, характерна для речовин молекулярної будови. Неполярно пов’язані атоми одного елемента, а полярно — різних, але ненабагато відрізняється электроотрицательностью. Зазвичай таким чином поєднуються елементи-неметали, але бувають і винятки, такі як алюміній.








