Ідеальні та реальні гази
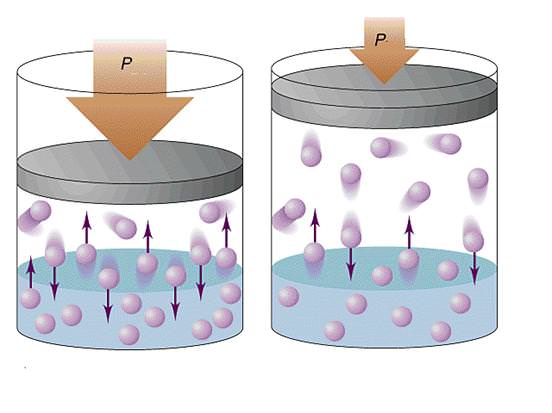
Кожному школяреві відомо властивість газу, згідно з яким він може займати будь наданий йому об’єм. Якщо перевірити цю властивість на практиці, то виявиться, що воно практично ніколи не виконується: настає момент, коли газ перестає розширюватися, хоча можливість для цього є. Цей факт пов’язаний з наявністю міжмолекулярних взаємодій в газах.
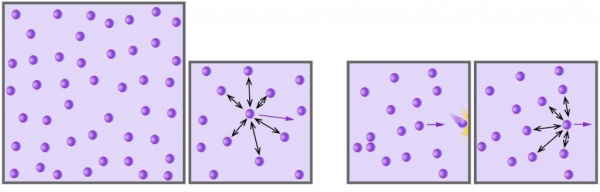
Концепція ідеального газу базується на двох важливих умов:
Викладене вище можна резюмувати наступним чином: газове стан можна вважати ідеальним тільки при низьких тисках (щільності), високих температурах та високій хімічній інертності складових частинок.
Якщо зазначені умови не виконуються, то математичний опис поведінки газів відрізняється від ідеального.