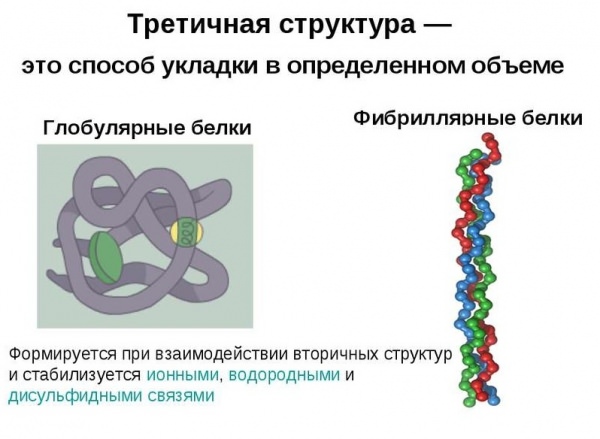
Приклади фібрилярних і глобулярных білків
До глобулярным білків можна віднести всі протеїни, розчинені в міжклітинної та внутрішньоклітинної середовищах, а також у плазмі крові. Сюди відносять ферменти, білкові гормони, фактори транскрипції, імуноглобуліни і так далі. Класичним зразком глобулярного білка можна назвати гемоглобін.
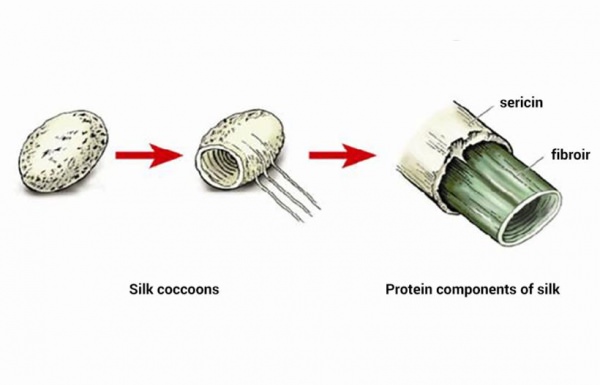
Сферичні протеїни виконують безліч функцій, тоді як волокнисті — лише структурну. Типовим прикладом фібрилярних білків є колаген, еластин і кератины. До групи волокнистих протеїнів відносять також фіброїн, з якого складається шовкова нитка, і фібрин, що формується при полімеризації фібриногену в процесі згортання крові.
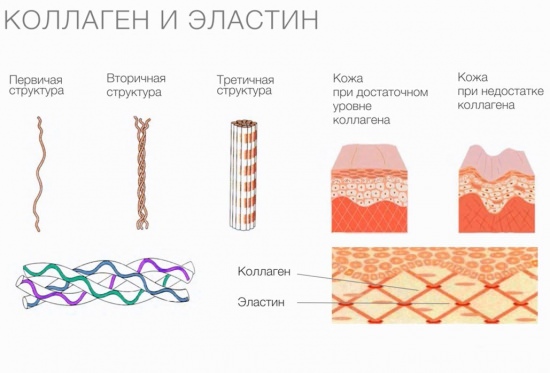
Колаген
Колаген — найпоширеніший фибриллярный протеїн багатоклітинних тварин. Він входить до складу сполучної тканини, забезпечуючи її міцність і еластичні властивості. Цей білок присутній в:
- хрящах;
- дермі;
- сухожиллях;
- органічному матриксі кісток;
- стінках судин;
- органічному матеріалі кісткової тканини.
Колаген складається з трьох амінокислотних ланцюгів, скручених у спіраль і з’єднаних один з одним ковалентными зв’язками. Структурні одиниці цього білка називаються тропоколлагенами. Останні з’єднуються один з одним кінцями, зміщеними один щодо одного на відстань у 67 нанометрів.
У залежності від локалізації в організмі розрізняють 28 типів колагену. У всіх різновидів обов’язково присутній хоча б один домен з потрійною спіраллю. Колаген складає основу всіх типів сполучної тканини. Структурні компоненти цього білка утворюють дуже міцні фібрили, які здатні витримувати значні навантаження.

Колаген виконує опорні і захисні функції, а також забезпечує еластичність тканин. Однак молекули цього протеїну не володіють здатністю розтягуватися. Резіноподобниє властивості характерні для іншого білка, також присутнього в сполучних тканинах, — еластину.