За особливості укладання в тривимірному просторі розрізняють дві великі групи білків: глобулярні і фібрилярні. Більшість протеїнів відноситься до першої фракції, яка відповідає типовій моделі третинної структури, що описує аминокислотную ланцюг як сферичний клубок з гідрофобним центром і гідрофільною поверхнею. Фібрилярні білки — це специфічна група, що характеризується ниткоподібний формою молекул.
Загальна характеристика просторової структури білка
У первісному вигляді синтезований білок являє собою лінійну ланцюжок амінокислот, сполучених один з одним пептидними зв’язками. Однак на шляху до кінцевої функціональній формі молекула перетерплює кілька стадій просторової укладки за рахунок різних хімічних взаємодій. Кожен етап формування позначений відповідними структурами: первинної, вторинної, третинної і четвертинної (якщо є).
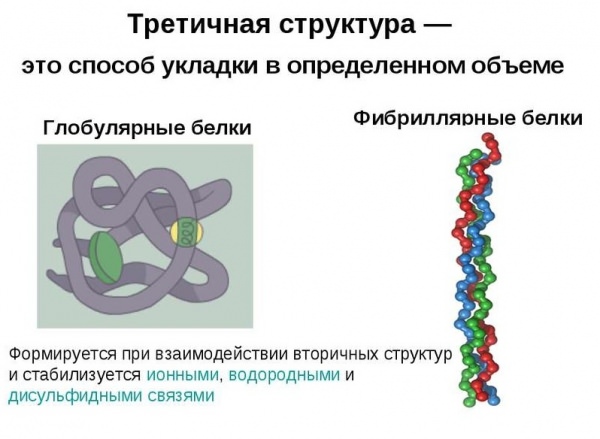
Глобулярні білки характеризуються тривимірної просторової конформацией, яка утримується комплексом слабких хімічних зв’язків (водневі, іонні, гідрофобні і т. д.). По формі молекула такого протеїну нагадує сферичний клубок.
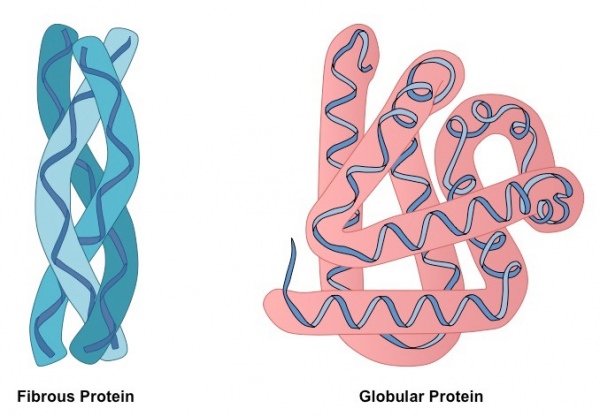
Поліпептидні ланцюги фібрилярних білків формують довгі волокна, які складаються з повторюваних елементів вторинної структури. Пристрій третинної конформації ниткоподібних протеїнів порівняно з глобулой значно примітивніше, однак забезпечує хорошу стабільність.








