Число ступенів свободи і внутрішня енергія
Під числом z розуміють кількість можливих варіантів руху певної газової частинки. Так, для кожної з них існує 3 ступеня свободи руху в тривимірному просторі поступального. Крім них, для двоатомних молекул є можливість обертатися навколо двох взаємно перпендикулярних осей, тобто для них z = 5. Якщо молекула більш складна (трьох-, четырехатомная і так далі), то вона може обертатися навколо трьох осей у просторі, тобто для неї z = 6.
З урахуванням вищесказаного, можна записати наступні формули для внутрішньої енергії:
U1 = 3 / 2 * n * R * T (одноатомний газ);
U2 = 5 / 2 * n * R * T (двоатомний газ);
U3 = 3 * n * R * T (багатоатомний газ).
Процес ізотермічний і ΔU
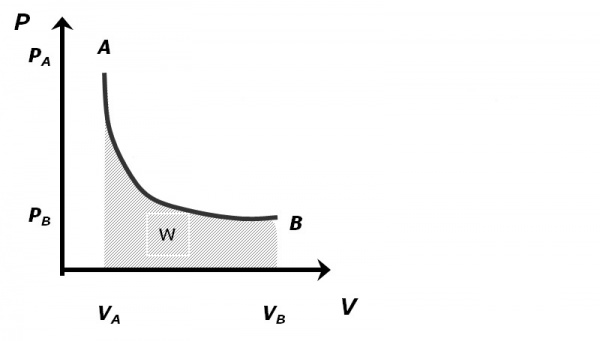
Ізотермічний процес є одним з перших переходів газу з одного стану в інший, який європейські вчені почали вивчати ще у XVII столітті. Ізотермічний процес для ідеального газу описується так званим законом Бойля-Маріотта, який математично виглядає так:
P * V = const при T = const.
Щоб визначити зміну внутрішньої енергії ідеального газу, необхідно з її кінцевого значення відняти початкова, тобто:
ΔU = U2 – U1.
Підставляємо в формулу для U, наведену в статті раніше, отримуємо:
ΔU = z / 2 * n * R * (T2 – T1) = 0.
Оскільки температура в ході ізотермічного процесу підтримується постійною (T2 = T1), то дорівнює нулю зміна внутрішньої енергії. Кількість теплоти Q, повідомлене системі, повністю витрачається на здійснення роботи A газом.








