Парціальний тиск компонента
Щоб зрозуміти суть закону Дальтона, необхідно розібратися з поняттям “парціальний тиск”.
Оскільки молекули різних газів не “відчувають” один одного, для кожного хімічного компонента i в газовій суміші буде справедливо рівність:
Pi*V = ni*R*T.
Тобто можна вважати кожен компонент незалежним від інших. Оскільки його молекули займають весь об’єм V і мають температуру T, характерну для всієї суміші, то звідси і випливає справедливість записаного виразу.
Тиск Pi називається парціальним для i-го компонента. Іншими словами, парціальний тиск – це тиск, який тільки i-й компонент створює на стінки посудини. Парціальним воно називається тому, що є частиною від загального тиску, або його порцією.
Формулювання закону Дальтона

У перші роки XIX століття, займаючись вивченням поведінки різних газових сумішей, британський вчений Джон Дальтон встановив наступний факт: якщо підсумувати всі парціальні тиски компонентів газової суміші, то вийде загальний тиск, яке можна виміряти барометром, манометром або іншим призначеним для цього приладом. Це і є закон Дальтона. Запишемо його у вигляді математичного рівняння:
Ptot = ∑i(Pi).
Зрозуміти, чому це рівність справедливо, можна, якщо згадати, що компоненти суміші створюють тиск незалежно один від одного.
Враховуючи, що парціальний тиск Pi прямо пропорційно кількості речовини ni компонента i, що справедливо завжди, коли T=const і V = const, тоді приходимо до ще одного рівності:
Pi/Ptot = ni/n = xi.
Величина xi називається мольной часток. З атомними відсотками ai компонента вона пов’язана простим співвідношенням:
ai = xi*100.
Вираз, який дозволяє визначити мольную частку компонента через його парціальний тиск і навпаки, також називається законом Дальтона.
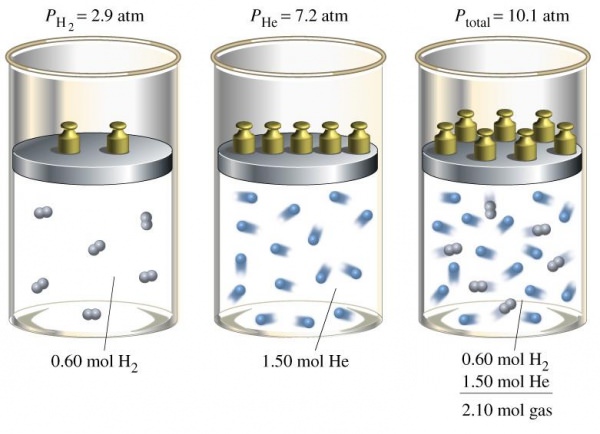
Слід не забувати, що розглянутий закон справедливий не тільки у випадку ідеальних газів, але й у випадку відсутності хімічних реакцій в них. Останні призводять до змін компонентного та мольного складу, що порушує закон для тиску газової суміші.








