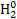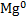Правила визначення ступеня окиснення
Як дізнатися ступінь окиснення? При роботі з окисно-відновними реакціями важливо знати, що формальний заряд частинки завжди дорівнюватиме величині електрона, вираженого в числовому значенні. Ця особливість пов’язана з тим припущенням, що електронні пари, що утворюють зв’язок, завжди повністю зміщуються в бік більш негативних часток. Слід розуміти, що мова йде про іонних зв’язках, а в разі реакції при ковалентного зв’язку електрони будуть ділитися порівну між однаковими частками.
Окислювальне число може мати як позитивні, так і негативні значення. Вся справа в тому, що у процесі реакції атом повинен стати нейтральним, а для цього потрібно або приєднати до іону певна кількість електронів, якщо він позитивний, або забрати їх, якщо він негативний. Для позначення цього поняття при записі формули зазвичай прописують над позначенням елемента арабську цифру з відповідним знаком. Наприклад,
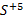
або

і т. д.
Слід знати, що формальний заряд металів завжди буде позитивним, а в більшості
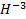
випадків, щоб визначити його, можна скористатися таблицею Менделєєва. Існує ряд особливостей, які необхідно враховувати, щоб правильно визначати показники.
Як визначити ступінь окислення
Ступінь оксидації:
- У простих елементів завжди дорівнює нулю:

або

.
- У фтору завжди буде дорівнює -1.
- Як і у металів, у елементів з груп IA, IIA і IIIA груп завжди однакова – це номер групи, в якій вони розташовані.
- У кисню у будь зв’язку дорівнює -2, крім зв’язків з пероксидами (Н2О2), коли значення дорівнює -1, і оксидом фтору (O+2F2-1, O2+1F2-1), коли вона дорівнює +2.
- У водню завжди +1, крім його взаємодії з гідридами (Na+H – і зв’язками типу C+4H4-1).
- У простого речовини без зв’язків з іншими елементами завжди дорівнює нулю.
- У простого йона з одним атомом дорівнює числу його електрона (Na+, Ca+2).
- Якщо розглядається зв’язок двох речовин різної природи (метал і металоїд), то негативне окислювальне число буде спостерігатися у речовини, яка володіє більшою электроотрицательностью (H+F-, Cu+Br-), а позитивне, відповідно, елемента з электроотрицательностью більше нуля.
- У лужних металів, таких як літій, натрій, калій та інших, завжди +1.
- У металів з головної підгрупи II (магній, барій, кальцій і стронцій) дорівнює +2.
- У алюмінію завжди однакове значення — +3.
Запам’ятавши ці особливості, достатньо просто буде визначати окислювальне число у елементів, незалежно від складності і кількості рівнів атомів.