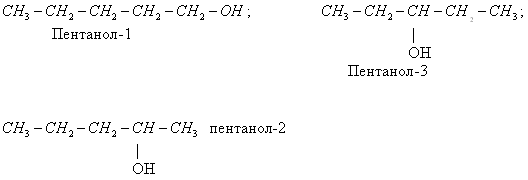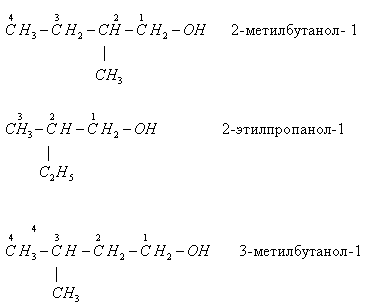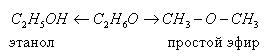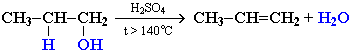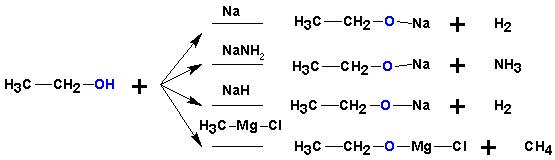Хімічні властивості спиртів це їх реакції при взаємодії з іншими сполуками, обумовлені гидроксилами.
Вони майже нейтральні: не змінюють колір індикаторів, не реагують ні з розведеними кислотами, ні з лужними та водними розчинами.
Але в певних реакціях демонструють властивості дуже слабких основ і кислот.
Класифікація спиртів
Атомность визначається так:
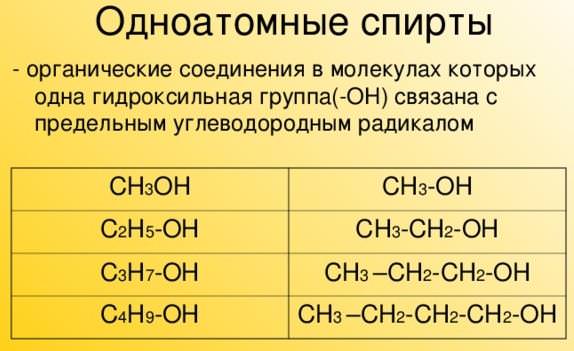
- В молекулі одноатомного спирту є одна гидроксогруппа: СН3 – СН2 – СН2ОН (пропанол С3Н7ОН).

- В молекулі багатоатомного спирту є дві або більше гидроксилы: СН2ОН — СН2 — СН2ОН.

Спирти класифікуються за трьома характеристиками:
- Кількість гідроксилов:
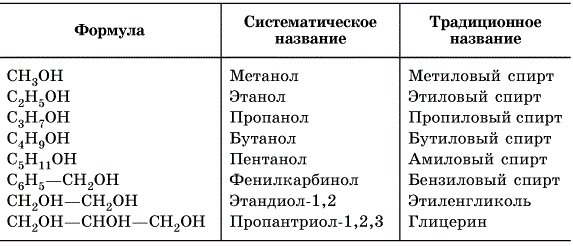
- одноатомні (етанол С₂Н₅ОН, СН₃СН₂ОН);
- двоатомні (етиленгліколь C₂H₆O₂, C₂H₄(OH)₂);
- багатоатомні (гліцерол C3H5(OH)3);
- Характер вуглеводневого радикалу:
- ненасичені похідні ненасичених вуглеводнів, атом водню в молекулах яких заміщується на гидроксогруппу: алліловий спирт Н2С = СН — СН2 — ОН;
- граничні — похідні насичених вуглеводнів, у яких один або більше водневих атомів заміщуються на гидроксогруппу. Формула: R — ВІН, де R — радикал: CH3 — CH2 — OH (етанол);
- ароматичні включають OH в бічній ланцюгом (бензиловий спирт);
- Характер атома вуглецю, що має зв’язок з гидроксогруппой:
- первинні — гидроксогруппа розташована у атома вуглецю, що має зв’язок лише з ще одним його атомом (приклад: R — CH2 — OH (етанол));
- вторинні — гидроксоруппа розташований у атома вуглецю, який пов’язаний лише з двома сусідніми його атомами (приклад: R — СН(ОН) — R’ (пропанол – 2));
- третинні — гидроксогруппа розташована у атома вуглецю, пов’язаного з трьома сусідніми його атомами (приклад: R — C — OH (2-метілпропанол-2)).
Ізомерія
Поняття «ізомерія» ввів у хімію Й. Берцеліус в 1830 р., а справжнє обґрунтування було дано в 2 половині 19 століття.
Ізомерія — факт наявності химсоединений — ізомерів, що володіють ідентичною молекулярною масою і складом, але відмінних за місцезнаходженням або будовою атомів і за властивостями.
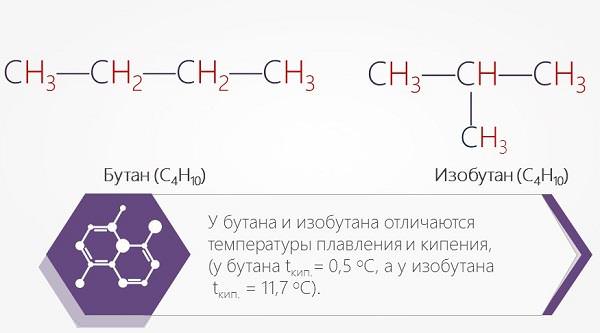
Так, формула бутану – С4Н10. Бутан, в молекулі якого вуглецеві атоми розташовуються у формі лінійної ланцюга, називають звичайним, а бутан, ланцюг атомів якого має розгалужену структуру, дають назву ізобутан.
Для граничних одноатомарных спиртів характерні три види ізомерії:
- ізомерія розташування функціональних груп і подвійного зв’язку:

- ізомерія вуглецевого скелета:

- міжкласова:

Номенклатура
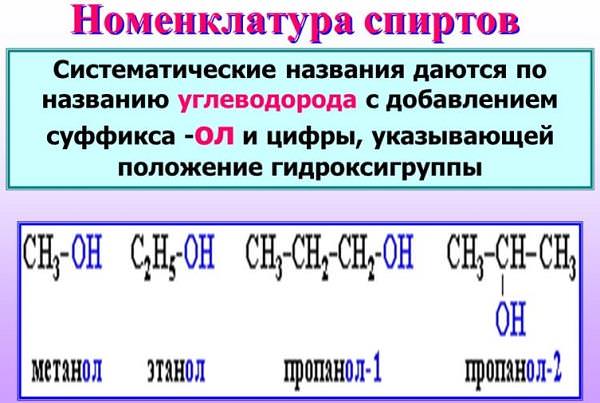
Як утворюється назва спирту?
Найменування спирту = найменування вуглеводню + префікс + -ОЛ + (n1, n2…, nn), що означає кількість гідроксил в молекулі: 2 – «ді», 3 – «три», 4 – «тетра» і т. д.
Присвоювання номери атомів вуглецю починається з закінчення, найближчого до гидроксогруппе.
Буква n повідомляє розташування гидроксогрупп в ланцюжку вуглеців.
Насичені одноатомарные спирти утворюють гомологічний ряд. Структурна формула алканолов: c n h 2n +1 OH. Відкриває ряд метанол CH3OH. Далі йде етанол C2H5OH. Потім – пропанол C3H7OH, бутанол C4H9OH і т. д.
Фізичні властивості спиртів
Коротка характеристика наступна:
- Температура кипіння і плавлення, як і вуглеводневих сполук, збільшується з підвищенням кількості атомів вуглецю в молекулі, але показники значно більше, ніж у вуглеводнів.
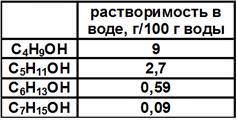
- Розчиняються у воді набагато краще вуглеводнів. З підвищенням кількості атомів вуглецю проявляється гідрофобний ефект, тобто розчинність у воді знижується. А при R, включає понад 9 вуглецевих атомів, майже зникає. Дані про розчинність коротко наведені в таблиці.

Причина – сильна полярність, формування H-зв’язків між молекулами води і спиртами;
Це цікаво: нижчих спиртів властивий специфічний аромат. Так, запах кішки виникає з-за того, що його головним елементом служить ізопропанол.
Хімічні властивості
Спиртів притаманні такі особливості:
- Реакції дегідрування. Внутрішньо молекулярне дегідрування з формуванням алкенів проходить у взаємодії з концентрованою Н2ЅО4 при нагріванні понад 140°С:

Міжмолекулярне дегідрування йде при температурі менше 140°С з формуванням простих ефірів:
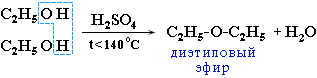
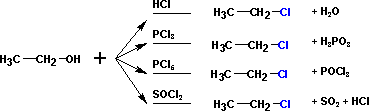
- Формування галоїдних алкилов (галогенирование) проходить при реагуванні з різними агентами:

Завжди краще проходять взаємодії з первинними спиртами, третинні часто викликають різноманітні побічні продукти;
- Кислотні властивості — здатність відщеплює За рахунок цього вони здатні реагувати з металами і лугами:

- Окислення проходить до кетонів та альдегідів з допомогою різних окислювачів;
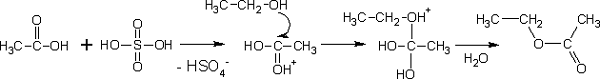
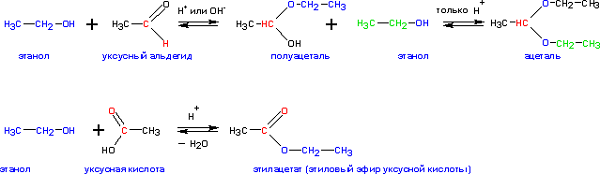
- Формування складних ефірів, які утворюються при реакції з мінеральними і органічними кислотами при помірному нагріванні:

- Формування ацеталей і кеталей при реагуванні з кетонами і альдегідами відповідно:

Способи отримання
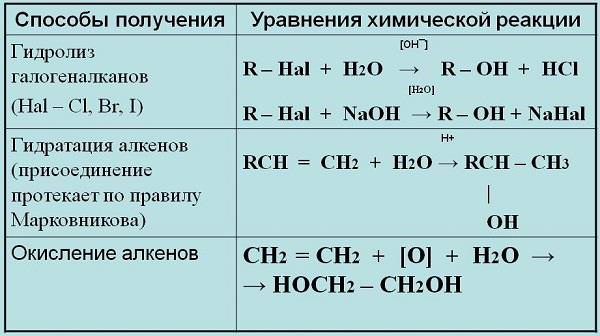
Отже, як же отримують спирти:
- Многоатомарные спирти формуються при гідролізі алкилгалогенидов, в яких присутній в одній молекулі більше одного атома галогену.
- H приєднується до молекул альдегідів в групі С = О по подвійний зв’язку. Результатом першого процесу будуть первинні спирти. Гідрування кетонів формує вторинні.
- Гліколі отримують шляхом окиснення алкенів водяним розчином марганцівки.
- Бродіння глюкози. Даний метод отримувати алкоголь здійснюється з давніх часів.
- Гідратація алкенів, при якій вода приєднує по тг-зв’язку молекули.
- Специфічні методи. Так, метанол виділяється при реагуванні H з оксидом вуглецю (II) при великій температурі і збільшеному тиску з участю каталізатора (оксиду цинку).
Застосування спиртів
Участь спиртів у безлічі реакцій дає можливість отримувати різноманітні органічні сполуки, що використовуються як розчинники при виготовленні барвників, ліків, медичного спирту та полімерів.
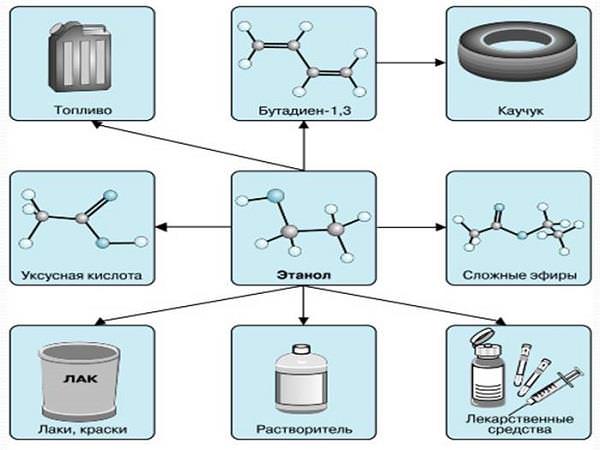
Бутанол С4Н10О може використовуватися в паливних елементах, як сировину для виробництва водню.
Штучні вищі жирні спирти (гексиловый спирт C6H13OH) добуваються з допомогою органічного синтезу і крім природних вищих жирних спиртів (жирів, восків і олій), застосовуються для отримання флотореагентов, розчинників, пластифікаторів, ароматичних рідин.
Висновок
Спирт – органічна сполука, що має різноманітний і широкий клас. Отримувати його різноманітні види можливо не тільки в лабораторіях, але і з природного середовища. Крім того, деякі вітаміни належать до спиртів, наприклад, А, В8 і D.