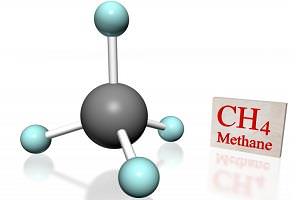
Хімічні властивості метану нічим не відрізняються від властивостей, притаманних усім речовинам класу алканів. У шкільному курсі хімії метан вивчають одним з перших речовин органіки, так як він є одним з найпростіших представників алканів.
У його складі один атом вуглецю і чотири атома водню.
Формула метану і способи його отримання
| Молекулярна формула метану | Структурна формула метану |
|
СН4 |
Н
| Н — С — Н | Н |
Метан у великих кількостях міститься в атмосфері. Ми не звертаємо уваги на знаходження цього газу в повітрі, адже на нашому організмі це ніяк не відбивається, а ось канарки дуже чутливі до метану.
Коли-то вони навіть допомагали шахтарям спускатися під землю. Коли процентний вміст метану змінювалася, птиці переставали співати. Це служило сигналом для людини, що він спустився занадто глибоко і потрібно підніматися нагору.

Утворюється метан в результаті розпаду залишків живих організмів. Не випадково з англійської methane перекладається, як болотний газ, адже він може бути виявлений в заболочених водоймах і кам’яновугільних шахтах.
Основним джерелом газу в агропромисловому комплексі є рогата худоба. Так, метан вони виводять з організму разом з іншими продуктами життєдіяльності. До речі, збільшення числа рогатої худоби на планеті може призвести до руйнування озонового шару, адже метан з киснем утворюють вибухонебезпечну суміш.
Метан в промисловості можна отримати з допомогою нагрівання вуглецю і водню або синтезу водяного газу, всі реакції протікають у присутності каталізатора, найчастіше нікелю.
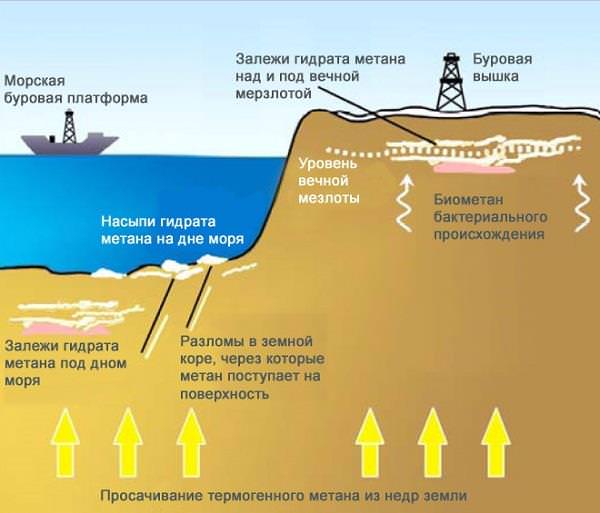
У США розроблена ціла система по видобутку метану, вона здатна отримати до 80% природного газу з вугілля. На сьогоднішній день світові запаси метану оцінюються експертами в 260 трильйонів метрів кубічних! Навіть запаси природного газу значно менше.
В лабораторії метан отримують шляхом взаємодії карбіду алюмінію (неорганічне з’єднання алюмінію з вуглецем) і води. Також за допомогою гідроксиду натрію, вступає в реакцію з ацетатом натрію, більш відомого як харчова добавка Е262.








