Агрегатний стан речовини, яке не здатне зберігати свій об’єм і форму у відкритому просторі при впливі малих зовнішніх сил, називається газом. Існує чотири макроскопічних параметра газу, які можна виміряти і обчислити. Одним з них є тиск. У наведеній нижче статті вивчимо питання, за допомогою яких формул тиск газу можна обчислити.
Що таке тиск?
У фізиці під тиском розуміють величину, рівну відношенню механічної сили F, яка перпендикулярно впливає на поверхню деякої площі S, тобто:
P = F / S.
З рівності випливає, що вимірюватися величина P має в ньютонах на квадратний метр (Н/м2). В СІ ця одиниця називається паскалем (1 Па = 1 Н/м2).
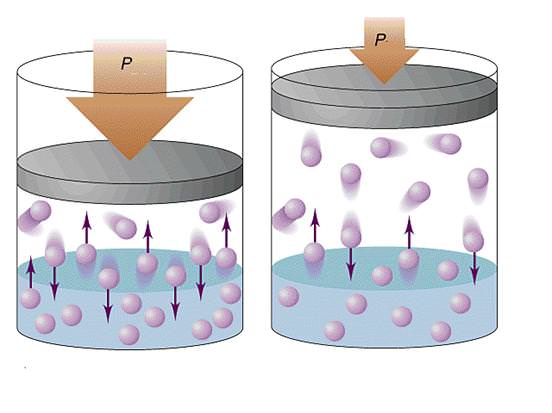
У разі газів тиск виникає за рахунок зіткнень зі стінками судин газових частинок. Останні можуть бути атомами або складними молекулами. У будь-якому газі частинки хаотично рухаються в різних напрямках. Їх зіткнення зі стінкою судини призводить до передачі останньої деякої кількості руху, що створює ефект впливає сили. Так як число стикаються зі стінкою частинок є величезним, то в середньому вони створюють деякий постійний тиск, що може бути виміряно на практиці за допомогою барометра або манометра.








