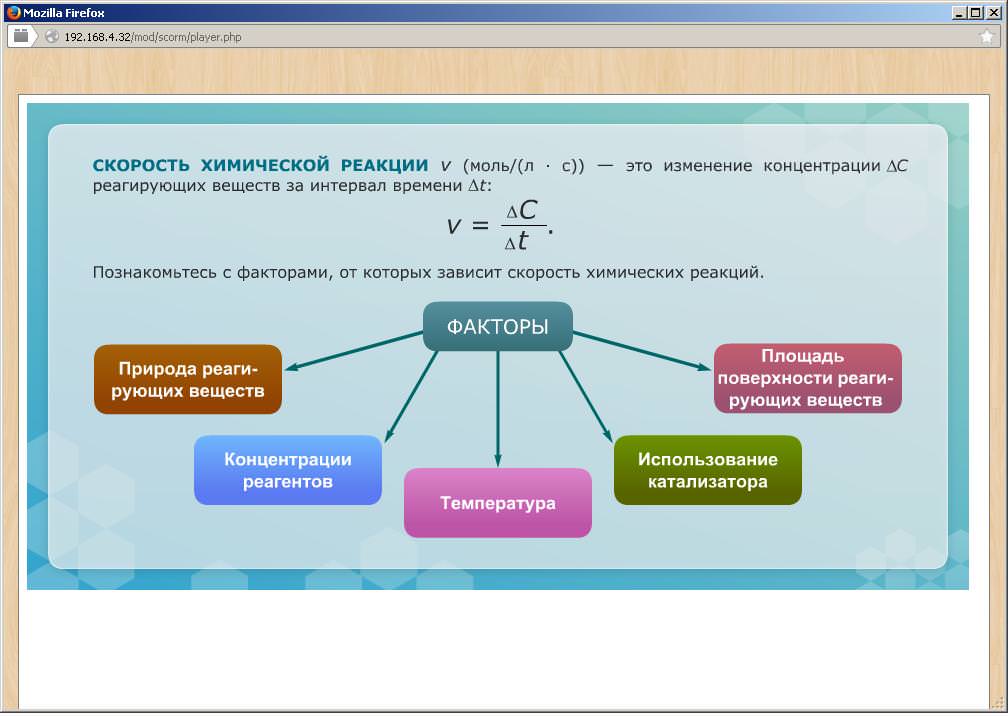
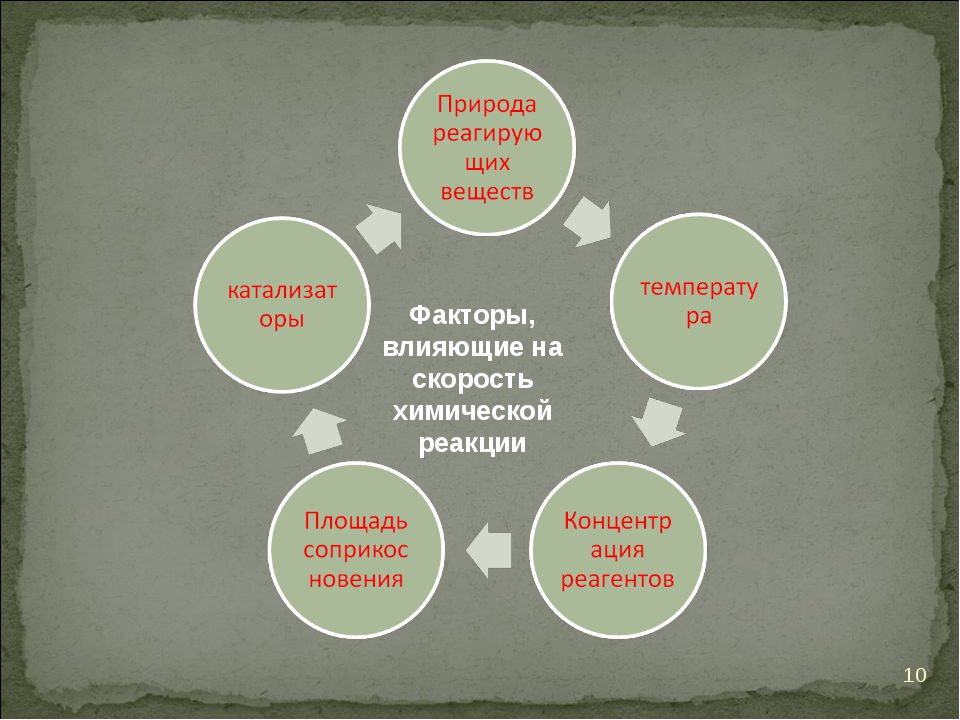
Фактори, що впливають на швидкість реакції

Поєднуючи хімічні речовини, отримують реакцію, яка в різних умовах протікає з різною швидкістю. Наприклад, при комбінації водню і кисню в газовому стані суміш довгий час перебуває в бездіяльності, але якщо ємність струсити або вдарити, то реакція закінчиться вибухом.
У зв’язку з такими особливостями фахівці хімічної кінетики виділили низку факторів, що мають здатність впливати на швидкість проходження хімічної реакції.
Серед таких умов розрізняють:
- природні властивості реагуючих компонентів;
- концентрація реагентів;
- температурні перепади;
- застосування каталізатора;
- скачки тиску (при використанні газоподібних компонентів);
- площа взаємодії речовин.
Природні властивості реагентів

Велика різниця у швидкостях химреакций обумовлена різними коефіцієнтами енергії активації – зайвого обсягу енергії, кількість якого перевищує середні значення, необхідні часткам для зіткнення і здійснення взаємодії. Параметр має свою одиницю виміру кДж/моль. Ці значення варіюються від 50 до 250.
При надлишку енергії в кількості 150 кДж/моль в нормальних умовах реакція не протікає. Об’єм виділеної енергії витратиться на запобігання відштовхування молекул, мінімізацію зв’язків всередині речовини. Від активаційної енергії залежить міцність химсвязей в інгредієнтах. Значення енергії відображає активність реакції:
- менш 40 – взаємодія проходить швидко, всі удари молекул закінчуються реакцією;
- більше 40, але менше 120 – середня швидкість, тільки половина зіткнень є ефективними;
- більше 120 – повільне взаємодію, оскільки незначна частина зіткнень частинок закінчується реакцією.
Концентрація речовин

Кількість молекул в одиниці об’єму впливає на швидкість взаємодії. Процес підпадає під закон діючих мас. Закон застосовується для найпростіших реакцій, що проходять за одну стадію. Також підходить для багатоетапних реакцій, коли процес відбувається на конкретній стадії.
Швидкість химпроцесса з урахуванням вимог закону визначається формулою V=k·[A]a·[B]b. У математичному рівнянні a і b виступають в ролі стехіометричних коефіцієнтів, [A] і [B] – це концентрації реагентів, k є константою швидкості.
Значення швидкості відображає ідентичний коефіцієнт, якщо концентрації реагуючих інгредієнтів дорівнюють одиниці. Для коректних розрахунків з використанням формули потрібно брати до уваги агрегатний стан компонентів. Концентрація твердого інгредієнта дорівнює одиниці, тому рівняння не входить, так як під час реакції вона не змінюється.
Для визначення коефіцієнта швидкості в формулу включають виключно компоненти рідкого і газоподібного стану.
Температурний режим

Протягом химреакции залежить також від температурних умов. Дослідним шляхом виявлено, що активність деяких хімічних процесів збільшується в кілька разів, якщо температуру підняти мінімум на 10 градусів. Наступні 10 градусів також провокують збільшення активності в 2-4 рази.
На жаль, не вивчено механізм впливу температури на швидкість окремо взятої реакції. Також не визначено перелік закономірностей. Можна припустити з точки зору логіки, що зростання температури сприяє посиленню хаотичного руху молекул і атомів, в результаті чого кількість їх зіткнень значно зростає.
Однак від цієї особливості впливу не збільшується ефективність зіткнення частинок, адже головним каталізатором цього процесу є енергія активації. Також для ефективності взаємодії молекул необхідно їх просторове відповідність.
Застосування каталізаторів
Активність реакції в хімії вивчає також і інший напрям, який називається каталіз. Його завдання – з’ясувати, як і за яким алгоритмом невеликі обсяги зазначених речовин збільшують швидкість відгуку реагентів. Такими речовинами називають каталізатори. Причому сам каталізатор, прискорюючи реакцію, практично не витрачається.
Прискорювачі здатні змінити механізм хімічного процесу і спровокувати утворення таких перехідних станів речовини, які мають більш низький енергетичний бар’єр. Каталізатор може скоротити енергію активації, збільшити число результативних зіткнень молекул. Якщо взаємодія енергетично неможливо, то використання прискорювача безглуздо.
Площа контакту компонентів
При змішуванні речовин, що перебувають у різних агрегатних станах, або компонентів, які не здатні об’єднатися в гомогенну суміш, на швидкість химреакции значною мірою впливає площа взаємодії інгредієнтів.
Це обумовлено перебігом гетерогенної реакції на кордоні контакту реагентів. Тобто чим ширше ця межа, тим більша кількість частинок стикається і провокує швидку реакцію.
Яскраві приклади таких властивостей:
- дрібні тріски горять набагато активніше, ніж цілі колоди;
- в рідини краще розчиняються подрібнені тверді речовини, ніж цілий шматок.
Важливо! При подрібненні твердого інгредієнта відбувається довільне руйнування кристалічної решітки реагенту, тому реакційні властивості частинок збільшуються.
Вплив тиску

Перепади тиску під час реакції можуть вплинути на активність, тільки коли в якості реагентів застосовуються газоподібні речовини. Високий тиск сприяє збільшенню кількості молекул компонента в одиниці об’єму, густина реагенту зростає. При низькому тиску кількість частинок зменшується, отже, концентрація знижується.
Швидкість хімічної взаємодії – це кількість і ефективність зіткнення молекул реагентів. Цей процес може відбуватися швидше або повільніше, якщо створити відповідні умови. На зростання швидкості можуть впливати фактори, які можна різною мірою регулювати:
- температурний режим;
- рівень концентрації реагуючих компонентів;
- збільшення або зменшення тиску;
- перетворення різнорідних компонентів в однаковий агрегатний стан.








