Види алканів
Існує кілька видів алканових сполук, кожній з яких має свою формулу, будова, хімічні властивості та алкильный заступник. Таблиця містить гомологічний ряд
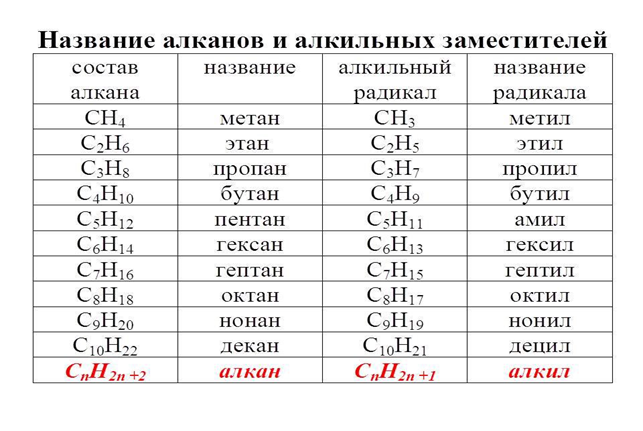
Назва алканів
Загальна формула насичених вуглеводнів — c n h 2n+2. Змінюючи значення n, отримують з’єднання з простою межатомной зв’язком.
Корисне відео: алкани — будова молекул, фізичні властивості
Різновиди алканів, варіанти реакцій
У природних умовах алкани є хімічно інертними з’єднання. Вуглеводні не реагують на контактування з концентратом азотної та сірчаної кислоти, лугом і перманганатом калію.
Одинарні молекулярні зв’язки визначають реакції, характерні для алканів. Алканових ланцюгів відрізняються неполярний і слабо поляризуемости зв’язком. Вона трохи довше, ніж С-Н.

Загальна формула алканів
Реакція заміщення
Парафінові речовини відрізняються незначною хімічною активністю. Пояснюється це підвищеною міцністю ланцюгової зв’язку, яку непросто розірвати. Для руйнування використовують гомологічний механізм, у якому беруть участь вільні радикали.
Для алканів більш природні реакції заміщення. Вони не реагують на молекули води і заряджені іони. При заміщенні відбувається заміна водневих частинок галогеновими та іншими активними елементами. Серед подібних процесів виділяють галогенирование, нитрирование і сульфохлорирование. Такі реакції використовують для утворення алканових похідних.
Вільнорадикальне заміщення відбувається у три основні етапи:
- Поява ланцюжки, на основі якої створюються вільні радикали. В якості каталізаторів використовують нагрівання і ультрафіолетове світло.
- Розвиток ланцюжка, у структурі якої відбуваються взаємодії активних і неактивних частинок. Так формуються молекули і радикальні частинки.
- На завершення ланцюжок обривається. Активні елементи створюють нові комбінації або зовсім зникають. Ланцюгова реакція завершується.
Галогенирование
Процес здійснюється за радикального типу. Галогенирование відбувається під впливом ультрафіолету і температурного нагріву вуглеводневої і галогенової суміші.
Весь процес відбувається за правилом Марковнікова. Суть його полягає в тому, що першим галогенированию піддається атом водню, що належить гидрированному вуглецю. Процес починається з третинного атома і закінчується первинним вуглецем.
Сульфохлорирование
Інша назва – реакція Ріда. Здійснюється вона методом вільнорадикального заміщення. Таким чином, алкани реагують на дію комбінації сірчаного і діоксиду хлору під дією ультрафіолетового випромінювання.
Реакція починається з активізації ланцюгового механізму. В цей час з хлору виділяються два радикала. Дія одного направлено на алкан, в результаті формується молекула хлорводорода і алкильный елемент. Інший радикал з’єднується з діоксидом сірки, створюючи складну комбінацію. Для рівноваги з іншої молекули відбирають один атом хлору. В результаті отримують сульфонилхлорид алкана. Цю речовину використовують для вироблення поверхнево-активних компонентів.
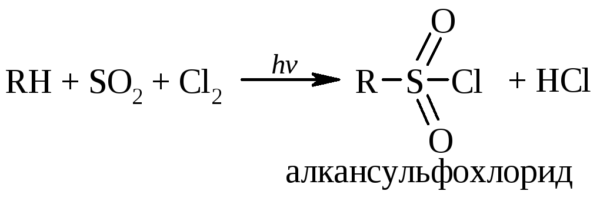
Сульфохлорирование
Нітрація
Процес нітрування передбачає поєднання насичених вуглеводів з газоподібним оксидом четирехвалентного азоту і азотною кислотою, доведеної до 10% розчину. Для протікання реакції потрібно низький рівень тиску і висока температура, приблизно 104 градуси. В результаті нітрування отримують нитроалканы.
Відщеплення
За допомогою відділення атомів проводять реакції дегідрування. Молекулярна частка метану повністю розкладається під впливом температури.
Дегідрування
Якщо від вуглецевої решітки парафіну (крім метану) відокремити атом водню, які утворюються ненасичені сполуки. Ці реакції здійснюються в умовах значних температурних режимів (400-600 градусів). Також використовуються різні металеві каталізатори.
Отримання алканів відбувається шляхом проведення гідрування неграничних вуглеводнів.
Процес розкладання
При впливі температур під час алканових реакцій можуть відбуватися розриви молекулярних зв’язків, виділення активних радикалів. Ці процеси відомі під назвою піроліз і крекінг.
При нагріванні реакційної компонента до 500 градусів, молекули починають розкладатися, а на їх місці формуються складні радикальні алкільні суміші. Таким способом отримують алкани і алкени в промисловості.
Окислення
Це хімічні реакції, засновані на віддачі електронів. Для парафінів характерно автоокисления. В процесі окислення використовується насичених вуглеводнів вільними радикалами. Алканових з’єднання в рідкому стані перетворюються в гідроперекис. Спочатку парафін вступає в реакцію з киснем. Утворюються активні радикали. Потім відбувається реакція алкільного частинки з другою молекулою кисню. Формується перекисный радикал, який в наслідок взаємодіє з алкановой молекулою. В результаті процесу виділяється гідроперекис.

Реакція окислення алканів








