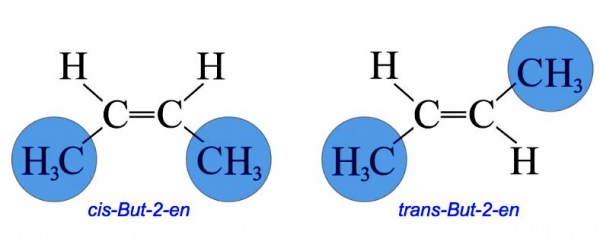
Геометричними ізомерами є цис-транс-изомеризм, або изомеризм EZ. Їх дії ґрунтуються на обмеженому обертанні подвійних або одинарних вуглецевих зв’язків у циклічних сполуках.У циклічному з’єднанні, обертання між вуглецевої одинарним зв’язком обмежено і дві різні групи приєднані до кожної вуглецевої ізомерії аналогічним чином. Такі геометричні ізомери часто відрізняються за своїм фізичним властивостям. Це пов’язано з формою ізомерів і загальним дипольним моментом. Якщо два атоми з найвищим пріоритетом залишаються на тій же стороні ізомеру, то вони позначаються як Z, і якщо вони знаходяться в протилежній стороні – E.
Коротка історія ізомерії
Концепція конституційної ізомерії – це значний крок вперед в історії сучасної хімії і, особливо в розвитку органічної хімії. Вже до кінця 1700-х років було виділено кілька чистих речовин шляхом вивчення «тваринної» і «рослинної» хімії. Багато були отримані Карлом Вільгельмом Шеєле (1742-1786 рр.). З-за великої різноманітності органічних сполук кожне нове речовина являло інший елементний склад, який відповідав узагальненого спостереження з «мінеральної» хімії. Кількість ізольованих органічних сполук збільшилася на початку 1800-х років, з допомогою ідентифікації різних речовин.
У своїй книзі з історії хімії Томас Томсон у 1830 році писав, що:
Берцеліус застосував теорію атома також до рослинного царства, проаналізувавши декілька рослинних кислот, і показуючи свою атомну конституцію, але тут виникає трудність, яку в нинішньому стані наших знань, ми не можемо подолати. Є дві кислоти, які складаються з таких самих атомів. Тепер, як ми повинні враховувати цю разючу різницю у властивостях? Безсумнівно, різними способами, в яких атоми розташованих в кожному з них.
Потім Томсон використовував різні схеми атомних символів, використовуваних в той час, щоб пояснити, чому дві кислоти з одним і тим самим елементарним складом, що належать до геометричним ізомеру мають різні фізичні і хімічні властивості.
До початку XIX століття вважалося, що ці хімічні речовини, виявлені в живих організмах, володіють особливою життєвою силою, пов’язаної з живими істотами, і що вони потрібні в живих системах для відтворення. У 1828 році Велер синтезував зразок сечовини, (NH2) 2CO (також CH4N2O), яка була неотличимой від сечовини, виділеної з біологічної сечі.
Він підготував це «тварина» речовину з явно неорганічного (мінералогічного) вихідної речовини цианата амонію (NH4)NCO (також CH4N2O), що є результатом об’єднання хлориду амонію і цианата срібла. Таким чином бар’єр між «живий» і «неживий» ізомерією звалився.