Статистичне розподіл енергій молекул
Оскільки стани речовини макроскопічного порядку являють собою результат поведінки великої сукупності частинок, вони описуються за допомогою статистичних методів. До останніх належить і з’ясування того, як розподіляються енергетичні параметри молекул газу:
- Максвелловское розподіл кінетичних енергій (і швидкостей). Воно показує, що в газі, що перебуває в стані рівноваги, більшість молекул має швидкостями, близькими до деякої найбільш ймовірної швидкості v = √(2kT/m0), де m0 – маса молекули.
- Больцмановское розподіл потенційних енергій для газів, що знаходяться в полі будь-яких сил, наприклад гравітації Землі. Воно залежить від співвідношення двох чинників: тяжіння до Землі і хаотичного теплового руху частинок газу. У результаті чим нижче потенційна енергія молекул (ближче до поверхні планети), тим вище їх концентрація.
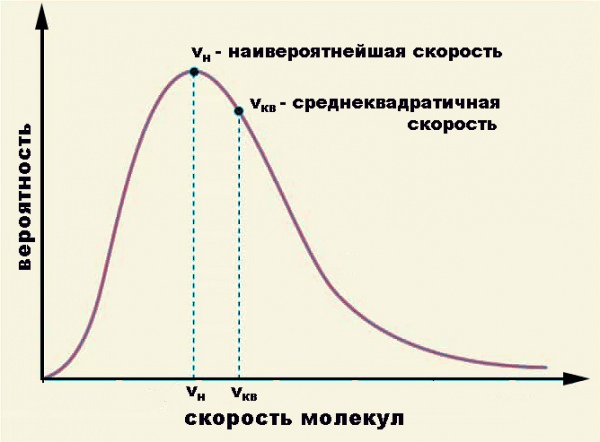
Обидва методу статистичних об’єднуються в розподіл Максвелла – Больцмана, що містить експоненціальний множник e–E/kT, де E – сума кінетичної і потенційної енергій, а kT – вже відома нам середня енергія теплового руху, керована постійної Больцмана.








