Це найпростіший трьохатомний спирт. Хімічна формула гліцерину — C3H5(OH)3. Являє собою прозору в’язку рідину. Не має запаху, солодка на смак. Він не отруйний, тому знаходить широке застосування в побуті, харчової промисловості, косметиці та медицині. Структурна формула гліцерину представлена на малюнку. Але як добувають його?
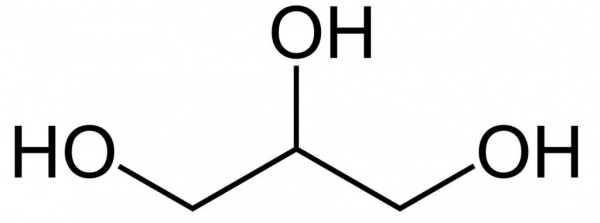
Способи отримання гліцерину
Майже весь гліцерин у промисловості одержують із жирів. Вони з хімічної точки зору якраз і являють собою складні ефіри гліцерину. При омылении цих жирів (отримання мила) гліцерин утворюється як побічний продукт. Потім він дуже просто виділяється з реакційної суміші.
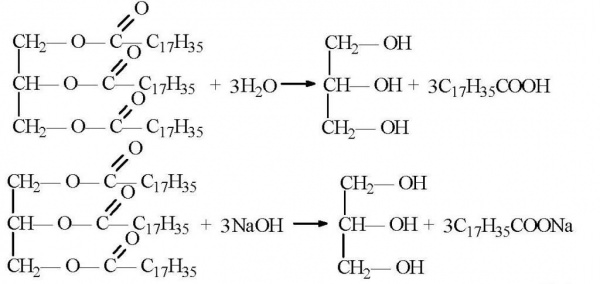
Синтезувати гліцерин можна і іншими способами. Наприклад, ацетону. В цьому випадку його відновлюють воднем, щоб отримати ізопропіловий спирт. На наступній стадії дегідратацією відщеплюють молекулу води, отримуючи пропілен, який потім хлорують. Отриманий дихлорпропан хлорують ще раз, для отримання трихлорпропана. Остання стадія отримання гліцерину — гідратація при нагріванні. На цій стадії всі три молекули хлору замінюються на гідроксильні групи. Схожим способом зараз в промисловості отримують синтетична речовина. Тільки в якості сировини використовують пропілен, який виділяється з побічних газів при перегонці нафти.
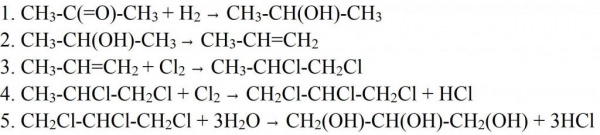
Але з пропілену отримувати гліцерин можна й іншим способом. Для цього пропілен окислюють в акролеїн. Окислення ведеться киснем повітря в присутності каталізатора (міді) і підвищеній температурі. Далі до нього приєднують перекис водню, отримуючи двоатомний спирт-альдегід. В якості каталізатора такої реакції використовується оксид осмію (VIII). Альдегидную групу в отриманому з’єднанні гідруван, перетворюючи її в третю гідроксильну. Так і виходить гліцерин.
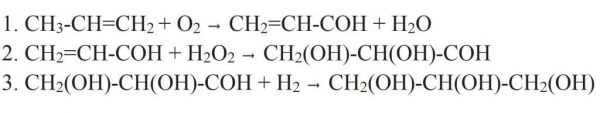
Інший варіант синтезу в свій час запропонував Е. Е. Вагнер. Окислюючи алліловий спирт перманганатом калію в лужному середовищі, можна в одну стадію отримати гліцерин.








