Зі шкільного курсу хімії відомо, що всі елементи, які згруповані за певними правилами в періодичну таблицю Менделєєва, можна умовно розділити на метали і неметали. У цій статті буде розказано про кристалічну будову металів, їх фізико-хімічних властивостях, а також про дефекти на атомному рівні, які в них присутні.
Періодична таблиця і метали
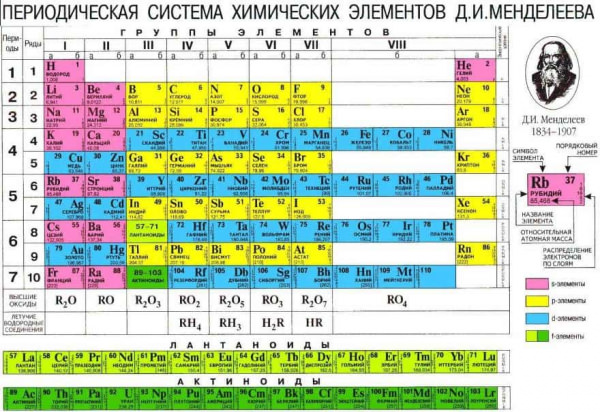
У XIX столітті завдяки своєму блискучому розуму і багатьох років праці Дмитро Іванович Менделєєв склав таблицю, зібравши в неї всі відомі на той час хімічні елементи. Кожному з них в таблиці відведено певне положення в відповідності з числом протонів в атомному ядрі. Вся таблиця ділиться на 7 періодів (горизонтальні рядки) і 8 груп (вертикальні рядки). Чим більше період, тим більше радіус атома елемента, і тим на більш високих орбіталях розташовані його валентні електрони. Навпаки, чим старша група (рух по таблиці зліва направо), тим більше валентних електронів знаходиться на останній орбіталі і тим менший радіус атома.
Будь-який елемент таблиці можна умовно віднести або до металів, або до неметаллам. Метали розташовані по ліву сторону від діагоналі бор (B) – полоній (Po). Якщо поглянути на таблицю, то можна відразу зрозуміти, що кількість металів у кілька разів перевищує число неметалів.








