Закон Бойля-Маріотта
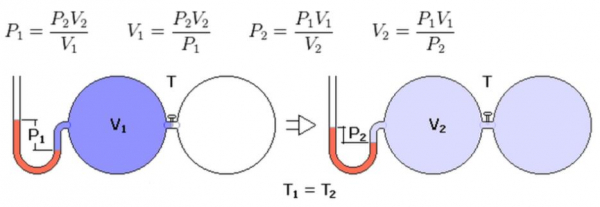
Саме так описується ізотермічний процес в ідеальному газі. В кінці XVII століття, проводячи експерименти із закритими системами, Роберт Бойль і Эдм Маріотт встановили наступне співвідношення між тиском і об’ємом:
P*V = const при T = const.
Умова сталості температури є ключовим для того, щоб тиск і обсяг були точно обернено пропорційні один одному.
Закон Бойля-Маріотта може бути отримано з рівняння Клапейрона-Менделєєва, яке має вигляд:
P*V = n*R*T.
Тут n і R – кількість речовини і константа для газів відповідно. Видно, що прийнявши абсолютну температуру за постійну величину в закритій системі (n=const), права частина рівності залишиться незмінною під час переходу між станами.
Графік ізотермічного процесу – це крива функції P(V). Нескладно побачити, що він являє собою гіперболічної залежність. Сам графік називається ізотермою. Чим вище температура T в системі, тим далі від осей об’єму і тиску буде проходити лінія.
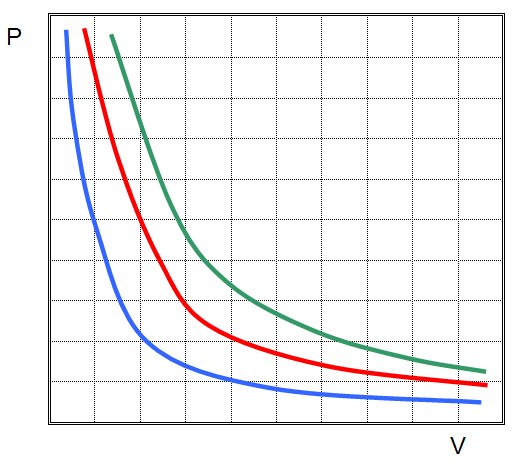
На малюнку вище наведені три ізотерми. Структурі з найбільшою абсолютною температурою відповідає зелена крива. У той же час, синя лінія описує поведінку системи з найменшою серед трьох температурою.