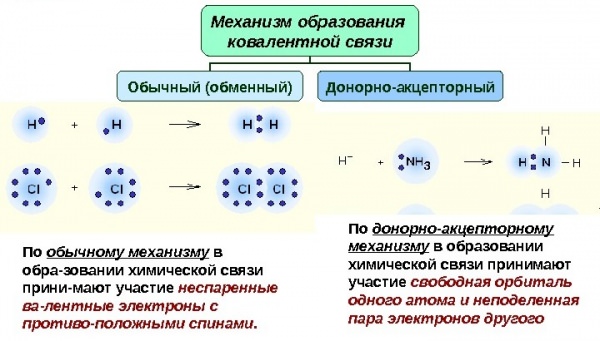
Донорно-акцепторний механізм утворення хімічного зв’язку передбачає перенос заряду між акцептором і донором без створення між ними спільної хімічного зв’язку. Також можлива передача неподіленої пари електронів до акцептору від донора, в результаті утворюється зв’язок.
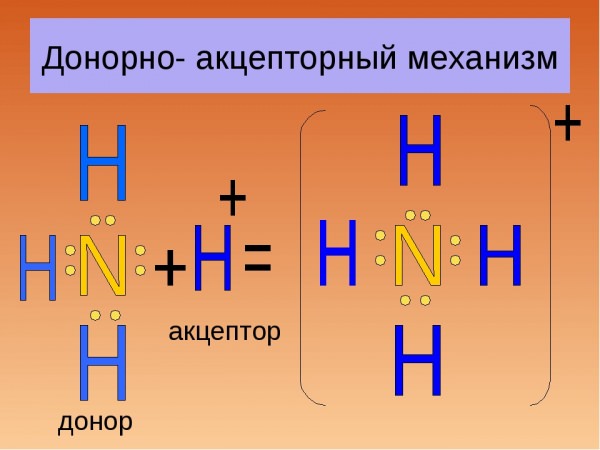
Утворення солей амонію
Розглянемо донорно-акцепторний механізм на прикладі солей амонію. Почнемо зі взаємодії аміаку (NH3) і трифториду бору (BF3). В процесі реакції відбувається виділення 171,4 кДж/моль енергії. Взаємодія протікає по рівнянню:
NH3 + BF3 = NH3BF3
З чотирьох орбіталей, наявних у атома бора, три заповнені електронами, отже, є одна вакантна орбіталь. В молекулі аміаку чотири орбіталі азоту укомплектовані електронами, причому три з них за обмінним механізмом доповнені електронами водню. Одна орбіталь має електронну пару, яка належить тільки атому азоту. Її називають неподіленої електронної парою. Саме завдяки їй можливе донорно-акцепторний механізм.
З’єднання між аміаком і трифторидом бору можливо завдяки тому, що вакантна електронна пара аміаку розміщується на вільної орбіталі фтористого бору.
Це донорно-акцепторний механізм утворення ковалентного зв’язку. Атом азоту збільшує валентність завдяки використанню неподіленої пари електронів для додаткової зв’язку. Бор підвищує валентність допомогою розташування на орбіталі додаткових електронів.
Таким чином, валентність цих хімічних елементів характеризується і неспаренными електронами, і неподеленными електронними парами, і вільними орбіталей на зовнішньому енергетичному рівні.