Водень, дейтерій, тритій
Нехай вас не дивує наведений вище перелік термінів. Мова йде про одному і тому ж хімічному елементі водні, заряд ядра атома якого дорівнює +1. Друге і третє назви – це імена ізотопів. Причина їх відмінностей полягає в кількості нейтронів в ядрі, тоді як протонное число всіх трьох видів частинок однаково. У дейтерію два нейтрона, у тритію – 3, сам же водень має 1 нейтрон у складі свого ядра. Вода, що містить в складі своїх молекул дейтерій, називається важкою. Її можна виявити у ставках-охолоджувачах атомних станцій, а також у складі цитоплазми клітин, що мають порушення нормального метаболізму.
Електронна будова атома водню
Схема, наведена нижче, допоможе нам зрозуміти специфіку поведінки простої речовини H2 в різних хімічних взаємодіях.
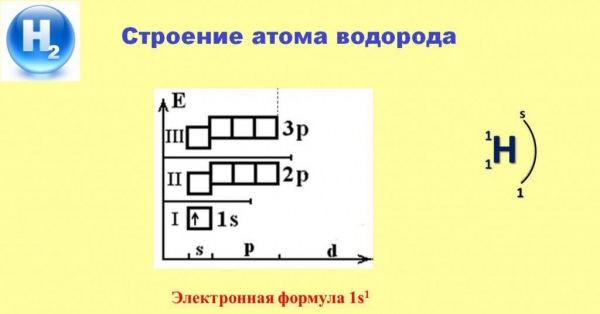
Наявність єдиного електрона, що зайняв s-орбіталь першого енергетичного рівня, забезпечує постійну валентність водню, що дорівнює 1. В більшості випадків цей електрон залишає простір атома і переходить у володіння більш электроотрицательных елементів. Лише реакції з металами дозволяють водню притягти у сферу впливу власного ядра електрон від активних атомів лужних або лужноземельних елементів, утворюючи білі кристалічні сполуки – їх гідриди.








