Отримання
Основна реакція отримання нерозчинних гідроксидів – це реакція взаємодії лугів із солями магнію. Наприклад, при взаємодії сульфату магнію з гідроксидом натрію. Це хороша ілюстрація. А ще приклад – при взаємодії хлориду магнію та гідроксиду калію.
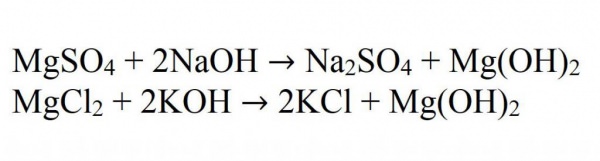
В іонному вигляді всі подібні реакції записуються як:
Mg2+ + OH- → Mg(OH)2
При взаємодії магнію або його оксиду з водою може також утворюватись гідроксид. Дана реакція йде дуже повільно і тільки при нагріванні.
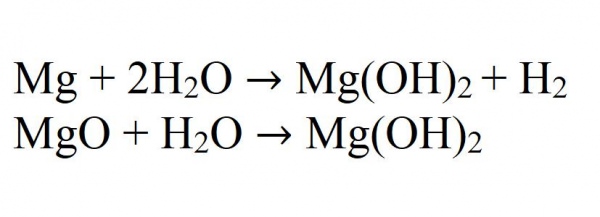
Існує такий досить поширений мінерал – доломіт. З хімічної точки зору він представляє суміш карбонату кальцію і магнію. При обробці цього мінералу водним розчином хлориду магнію при нагріванні в осад випадає нерозчинний гідроксид:
MgCO3·CaCO3 + 2H2O + MgCl2 → Mg(OH)2 + CaCl2 + 2CO2
Фізичні властивості
У сухому вигляді магнію гідроксид являє собою біле кристалічна речовина. Не має запаху, але йому властивий смак лугу. Він малорозчинний у воді (0,6 мг на 100 мл води). Але навіть незважаючи на це, його водні розчини мають слаболужне середовище і фарбують індикатори у відповідні кольори. Зате дане з’єднання розчиняється у розчинах солей амонію. Воно не плавиться, так як при температурі 480 oC розкладається на оксид магнію і воду, як і будь-яке інше нерозчинна основа. Щільність при нормальних умовах: 2,4 г/см3.








