Скільки аллотропних модифікацій має вуглець
У нашій статті мова піде про хімічний елемент, який утворює найбільшу кількість аллотропних форм. На даний момент їх відомо більше десяти. Вуглець – активний елемент. Різні модифікації він може утворювати завдяки наявності чотирьох вільних зв’язків. Молекулярна формула аллотропних модифікацій вуглецю буде абсолютно однакова для всіх форм – З. А от структура кристалічної решітки відрізняється.
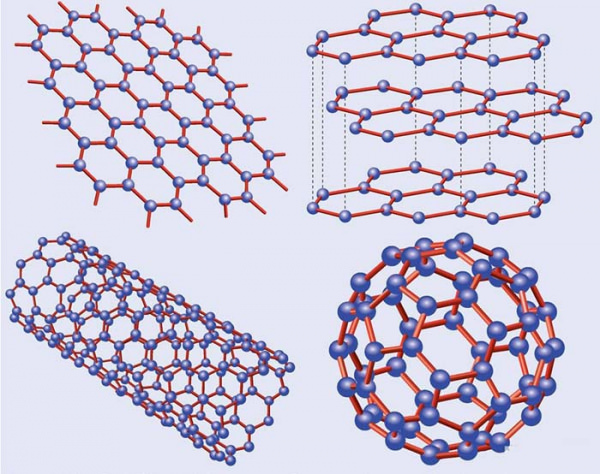
За характером хімічного зв’язку розрізняють кілька форм вуглецю. Прикладами тетраэдрической є алмаз і його гексагональний аналог – лонсдейліт. У кристалічних решітках цих речовин центральний вуглець у вузлах пов’язаний з іншими атомами.
Найбільш численними є тригональные форми. У цьому випадку вуглець утворює шестикутники, шари яких пов’язані між собою. Прикладами таких модифікацій є графіт, фулерени, нанотрубки, скловуглець, графены та інші речовини. У разі утворення ланцюжків вуглецю формується лінійна аллотропная форма. Її прикладом є карбін.