Чи відомо вам, що один і той же хімічний елемент може утворити кілька речовин? Причому властивості цих речовин будуть абсолютно різними. З нашої статті ви дізнаєтеся, скільки аллотропних модифікацій має вуглець, у чому їхня відмінність і яка область застосування.
Поняття аллотропии
Почнемо з визначення поняття. У перекладі з грецької мови “алотропія” означає “інша властивість”. Суть цього явища полягає в тому, що один елемент утворює кілька простих речовин. Їх називають аллотропными формами або модифікаціями.
Як це можливо? Існує два види аллотропии: складу і форми. У першому випадку вона обумовлена різним кількісним складом молекул простої речовини. Наприклад, при з’єднанні двох атомів оксигена утворюється кисень, трьох – озон.
При аллотропии форми молекула утворена однаковою кількістю атомів. Відрізняється спосіб їх розташування в кристалічній решітці. Так, до складу молекули сірки входить вісім атомів. Якщо вони утворюють замкнуту кільцеву структуру, виходить найбільш стійка модифікація – ромбічна сірка. Коли циклічна структура набуває форму корони, формується моноклинная сірка. А в разі утворення полімерних ланцюжків – пластична.
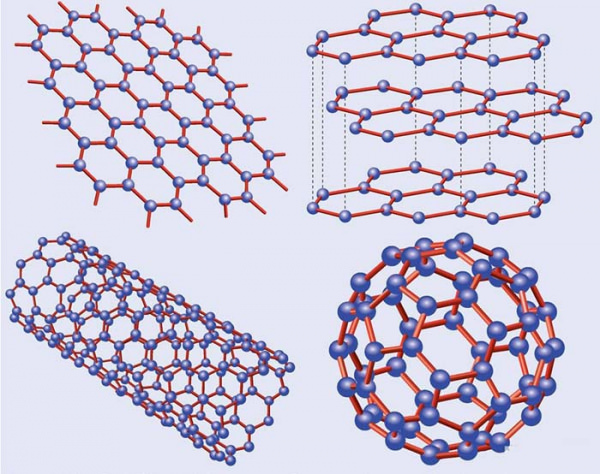
Фізичні властивості аллотропних модифікацій вуглецю, як і інших елементів, що мають характерні відмінності. Наприклад, білий фосфор візуально нагадує віск, а чорний – графіт. Кисень – це прозорий безбарвний газ, а озон – блакитного кольору з різким запахом. Суттєві відмінності мають алотропні модифікації вуглецю – алмаз і графіт.
Властивість аллотропии характерно тільки для елементів, які мають змінне значення ступеня окислення і здатні утворювати ланцюжки з атомів – гомоцепні структури.