Переходи між різними станами системи є основним об’єктом вивчення термодинаміки. Одним з таких перетворень, яке відіграє важливу роль в техніці і природі, є адіабатичний процес. Що він собою являє і якими описується рівняннями, розглядається в даній статті.
Визначення адіабатичного процесу
Якщо перехід між двома станами здійснюється тільки за рахунок внутрішніх енергетичних резервів розглянутої системи, то він називається адіабатичним. В результаті цього за рахунок таких ресурсів виконується певна робота.
Адіабатичний процес характерний для систем, які можуть легко стискатися і розширюватися. Цим умовам задовольняють всі гази. Обмін теплотою з навколишнім середовищем під час протікання цього процесу практично відсутній тому, що швидкість адіабатичного переходу виявляється дуже великий. З іншого боку, вона може бути маленькою, але при цьому система повинна володіти хорошою теплоізоляцією.
Графіки і рівняння адіабатичного процесу найпростіше вивчати на прикладі ідеальних газів, у яких внутрішня енергія точно дорівнює кінетичної енергії молекул.
Формули Пуассона

Розглянемо детальніше. Ті, хто знайомий з фізикою ідеального газу, знають, що кожне перетворення в такій системі підпорядковується деяким рівнянням. Наприклад, ізотермічний процес описується законом Бойля-Маріотта, ізобарний – законом Шарля, ізохорний – законом Гей-Люссака. Справедливо це і для розглянутої нами системи. Закон адіабатичного процесу теж має своє математичне вираження у вигляді рівняння Пуассона. Отримаємо їх.
Згідно з визначенням досліджуваного процесу можна записати наступний вираз:
dU = -P * dV
Ця рівність є першим законом термодинаміки, який встановлює збереження енергії в системі. Зокрема, робота P*dV виконується тільки за рахунок зміни внутрішньої енергії dU. Щоб отримати рівняння Пуассона, згадаймо такі співвідношення для ідеального газу:
dU = CV * dT;
P * V = R * T;
CP – CV = R
Перше рівність говорить про те, що при изохорном процесі зміна внутрішньої енергії виявляється прямо пропорційним температурі, де CV – изохорная теплоємність. Другий вираз – це закон Клапейрона-Менделєєва для 1 моль ідеального газу. Нарешті, третє рівність встановлює зв’язок між изобарной CP і изохорной CV теплоємність і газової сталої R для 1 моль речовини. Застосування всіх цих виразів дозволяє отримати наступні рівняння адіабатичного процесу:
P * Vγ = const;
T * Vγ-1 = const;
T * Pγ / (γ-1) = const
Всі три рівняння мають відношення до французькому математику і фізику XIX століття Симеону Пуассону.
Фізичний сенс
Величина γ називається показником адіабати. Він математично дорівнює відношенню теплоємності СР і СV. Оскільки ізобарна теплоємність завжди більше изохорной, то γ буде більше 1. Чому це відбувається? У разі изобарного процесу підводиться до системи теплота витрачається не тільки на її нагрів, але й на здійснення системою роботи.
На показник адіабати не впливає хімічний склад газу, проте він залежить від кількості ступенів свободи, що складають систему молекул. У загальному випадку справедлива наступна формула:
γ = (f + 2) / f
Тут f – число ступенів свободи. Для одноатомного газу воно дорівнює 3, для двоатомних – 5, а для багатоатомного – 6. З урахуванням цих цифр отримуємо значення γ:
γ = 1,67 (для одноатомного);
γ = 1,4 (для двоатомних);
γ = 1,33 (для багатоатомного)
У разі газової суміші, в яку входять молекули з різним числом атомів, слід розраховувати середнє значення γ з урахуванням атомних часток компонентів. Наприклад, земне повітря на 99 % складається з двоатомних молекул N2 та O2, тобто для нього показник γ для стандартних умов практично дорівнює 1,4.
Адіабатичний і ізотермічний процеси
Розглянемо наступні перетворення. Знайомі з фізикою люди могли помітити, що рівняння Пуассона, виражене через термодинамічні параметри P та V, які за своєю формою збігається з виразом Бойля-Маріотта для ізотермічного процесу в ідеальному газі. Останнє має вигляд:
P * V = const
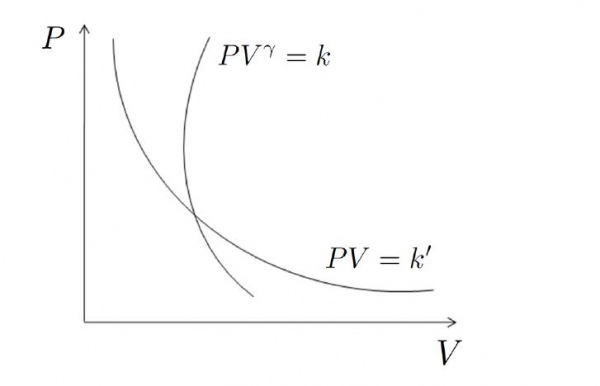
Якщо зобразити графіки адіабатичного і ізотермічного процесів в осях P-V, то можна побачити, що перша крива буде йти більш різко, ніж друга. Іншими словами, тиск у разі адіабатичного переходу падає швидше, ніж у випадку ізотермічного перетворення. Пояснимо цей факт. Слід згадати, що при ізотермічному розширенні в систему поставляється деяку кількість енергії для підтримки температури в ній, що сприяє більш повільному зниженню тиску.








