Фізика – це наука, яка складається з численних напрямів, одне з них – квантова фізика, яка займається вивченням найдрібніших частинок. Одним з важливих вчених у цій сфері є Нільс Бор, який на початку 20 століття запропонував неокласичну теорію будови атома і відкрив світові процеси, що протікають у ньому. Постулати Бора коротко описують ці процеси, і саме вони є фундаментом квантової фізики.
Значення постулатів Бора
Всі три постулати були сформовані датським вченим в результаті проведених численних експериментів і спостережень за поведінкою найдрібнішої частинки будь-якої речовини. У неокласичній теорії Бора коротко закладені три раніше представлених світу фізичних теорії:
- Формула Бальмера – Рідберга, що описує експериментальні закони, які допомагають показати лінійчатий спектр водневої молекули.
- Модель Резерфорда, до цього раніше не застосовувалася в курсі класичної фізики.
- Квантовий характер випромінювання, а також процес поглинання світлових променів найдрібнішими частинками.

Вчений використав ці дані і, застосовуючи класичний підхід, створив опис поведінки електрона. Це і є знамениті квантові постулати Бора. Слід згадати, що вони складно пояснити в рамках класичної фізики.
Більше того, спостерігаються відверті суперечності між ними і класичною теорією опису поведінки найдрібнішої частинки. Основні положення теорії Бора і її важливість змогла роз’яснити світу тільки квантова механіка.
При створенні неокласичної теорії вчений використовував в якості підстави свої експерименти з молекулами водню. Саме для цих часток (водневих і воднеподібних молекул) і були виведені постулати. Ці найдрібніші частинки складаються з ядра (заряд Zqe) і рухається навколо нього одиничного протона. Водородоподобные також мають один протон, наприклад, іон гелій (He+) або літію (Li2+).
Важливо знати! Нільс Бор створив свою теорію на підставі робіт Планка і Резерфорда, сенс якої ліг в основу квантової фізики.
Не всі результати і виведення фізика виявилися правдивими, багато хто з них згодом спростували. Але незважаючи на це, а також постійну критику (навіть Альберт Ейнштейн не сприймав його серйозно), вчений зміг своїми постулатами вплинути на розвиток квантової фізики і науки в цілому. Значення постулатів Бора:
- на час їх формулювання, вони були єдиним у світі логічним поясненням процесів, що відбуваються в найдрібніших частинках;
- пояснили закономірності руху протонів;
- разом з правилом квантування повністю підтвердили правдивість закону Менделєєва і законність його таблиці, а також пояснили закономірності оптичного та рентгенівського випромінювання;
- стали підставою для виведення теорій про поділ ядра і вимірювання швидкості цього процесу.
Таким чином, експериментальним шляхом і класичним підходом фізик з Данії зміг пояснити крихітні процеси, що відбуваються усередині найдрібнішої частинки і дати величезний поштовх для вивчення атома.
Перший
Правило стаціонарних положень, або перший постулат Бора, відомий тим, що говорить про рух електронів тільки по стаціонарних орбітах в ядрі. При цьому сама молекула повинна перебувати у визначеному положенні – квантовому. Але навіть тоді, рухаючись з збільшується швидкістю, вони не випромінюють ніякої енергії, незважаючи на те, що якась її частина все ж присутній і позначається певним числом — Е1, Е2 і так далі.
Саме цей постулат суперечить раніше виведеним теоріям класичної механіки, згідно з яким всі електрони мають енергію і виділяють її.
Більш того, дане правило суперечить і теорій електромагнетизму, виведених Джеймсом Максвеллом, оскільки Бор таким чином допустив ймовірність руху частинок молекули без випромінювання імпульсів в простір.

Перший постулат Бора
Другий
Правило частот, або другий постулат Бора, стверджує, що випромінюється атомом світло – це результат трансформації ядра з одного сталого стану з великою кількістю енергії в інше постійне стан, при якому в ньому вже буде її менший запас. При цьому математично можна виразити перше стан символом Ek, а другий стан (з меншою енергією) — En.
Фізик склав формулу, за якою можна розрахувати випромінюване фотоном в простір кількість енергії:
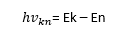
Після того, як з’явитися кількісне позначення випромінюваної сили, можна розрахувати частоту імпульсів. Формула проста, вона передбачає ділення отриманого результату на постійну Планка — h:
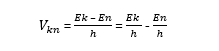
Дане наукове твердження має на увазі оборотність процесу, тобто ядро може повернутися назад у вихідне стан, і знову зберігати в собі великий запас енергії. Для цього йому необхідно поглинути в себе деяку кількість світлового випромінювання (квант).
Дане твердження також істотно суперечить вже виведеної теорії Джеймса Максвелла про електродинаміці, оскільки згідно з нею, частота випромінювання може бути визначена тільки як зміна енергії частинки, і жодним чином не залежить від руху електрона і його характеру.

Другий постулат Бора
Третій
Третій постулат Бора, або правило квантування, стверджує, що електрони в ядрі і самі ядра в молекулах рухаються по певних орбітах. І при переході частинок з однієї орбіти на іншу вони поглинають енергію, або її звільняють. При цьому рухається квантами випромінювання (альтернатива порціях), і їх можна обчислити науковим шляхом.
Це наукове твердження пізніше було детально вивчено іншими фізиками: Герцем і Франком, які підтвердили його шляхом наукового експерименту. У процесі вивчення даного твердження також був зроблений суттєвий стрибок у розвитку оптики, оскільки виведене правило довело, що атоми можуть поглинати і випромінювати тільки однакові спектри світла, причому поглинання завжди супроводжується великою кількістю енергії, а електрон переходить на дальню ядра орбіту.
Важливо! Вчений Кірхгоф раніше вже зробив такий висновок про поглинання електроном тих спектральних ліній, які він міг і випустити.

Третій постулат Бора
Поглинання світлових спектрів електроном є зворотним процесом випромінювання, при цьому спостерігається рух атома (електрона в його ядрі) з низьких енергетичних рівнів на верхні. В процесі цього руху частка поглинає ті ж самі випромінювання, які були нею вивільнені при зворотному процесі.
Таким чином, всередині молекул постійно відбувається рух найдрібніших частинок і поглинання/випромінювання. У Мережі сьогодні є безліч відео, які не тільки підтверджують правильність відкриттів датського вченого, але і прекрасно їх візуалізують.