Найпоширеніший елемент у космосі, що складається з найлегших атомів, – це водень. Він відкритий ще в 14 столітті великим алхіміком Парацельсом. Вченого по праву вважають основоположником не тільки медицини, але і хімії. Будова атома водню було в подальшому детально розглянуто Нільсом Бором. Елемент був виявлений астрономами у складі Сонця і інших планет, а також у газових зоряних туманностях. У них відбувається процес перетворення атомів водню на атоми гелію, іншими словами, спостерігається ядерна реакція. У нашій статті ми вивчимо не тільки будову атома водню, але і розглянемо характерні особливості властивостей цього хімічного елемента.
Місце елемента в періодичній системі Менделєєва
Водень – єдиний хімічний елемент, що знаходиться відразу в двох групах періодичної системи: 1 і 7. Пояснити такий факт можна так: він проявляє двоїсті хімічні властивості. Особлива будова атома водню дозволяє йому віддавати свій єдиний електрон атомів, наприклад, активних елементів – неметалів. Це насамперед галогени: агресивні по своїм властивостям фтор, хлор, бром і йод. Легко взаємодіє H2 і з халькогенами: сіркою, киснем, селеном. У цьому випадку атоми водню перетворюються на катіони – позитивно заряджені частинки.
Завдяки цій особливості елемент займає місце в першій групі періодичної системи. Інакше виглядає механізм реакції між металами і воднем. Згідно теорії будови атома водню за Н. Бору, елемент має один неспарений електрон. Атом H приймає електрони від атомів активних лужних або лужноземельних металів. Таким чином, його електронна конфігурація стає схожою на частку інертного газу гелію. Єдиний енергетичний шар тепер повністю завершено. У даних процесах будова атома водню змінюється і він переходить у форму аніона. Саме з цієї причини елемент одночасно розташований у періодичній системі ще і в її 7 групі.

Все в порівнянні
Продовжуючи вивчати особливості будови водневих частинок, давайте подивимося, наскільки їх внутрішня структура впливає на поведінку елемента в реакціях. Для цього звернемо увагу на його найближчих сусідів по періодичній системі та визначимо, яке будова атомів водню, гелію і літію. З частинками інертного газу водень об’єднує однакову кількість енергетичних рівнів, з літієм – схожу будову зовнішнього енергетичного шару, на якому розташований один електрон. Однак властивості водню сильно відрізняються як від інертного газу, так і від лужного металу. Цей факт доводить, що всі характеристики хімічного елемента порожниною визначаються будовою атома і молекули водню, тобто кількістю енергетичних рівнів і розподілом електронів на них.
Породжує воду
Назва елемента говорить про те, що з’єднання його атомів з частинками кисню приводить до появи такого унікального і важливого для Землі речовини, як вода. У звичайних умовах ця реакція не відбувається, температура горіння газової суміші досягає 2800 °C. У лабораторії взаємодія між H2 і O2 у співвідношенні 2:1 призводить до вибуху. Сама суміш отримала назву гримучого газу, а процес, що протікає в ній, йде по вільно-радикальному механізму. Якщо його не контролювати, то реакція закінчується серйозною проблемою – потужним вибухом. З цієї причини, незважаючи на його виняткову легкість, від водню відмовилися як від наповнювача для повітряних літальних апаратів. Сумним приводом послужило аварії в 1937 році дирижабля “Гінденбург”, що прямував до Америки. Подивимося тепер, як будова атома водню впливає на фізичні ознаки газу.

Водень, дейтерій, тритій
Нехай вас не дивує наведений вище перелік термінів. Мова йде про одному і тому ж хімічному елементі водні, заряд ядра атома якого дорівнює +1. Друге і третє назви – це імена ізотопів. Причина їх відмінностей полягає в кількості нейтронів в ядрі, тоді як протонное число всіх трьох видів частинок однаково. У дейтерію два нейтрона, у тритію – 3, сам же водень має 1 нейтрон у складі свого ядра. Вода, що містить в складі своїх молекул дейтерій, називається важкою. Її можна виявити у ставках-охолоджувачах атомних станцій, а також у складі цитоплазми клітин, що мають порушення нормального метаболізму.
Електронна будова атома водню
Схема, наведена нижче, допоможе нам зрозуміти специфіку поведінки простої речовини H2 в різних хімічних взаємодіях.
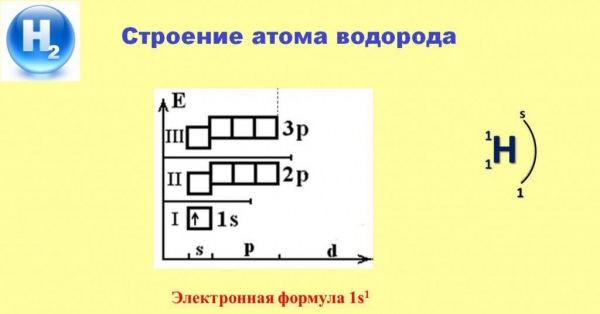
Наявність єдиного електрона, що зайняв s-орбіталь першого енергетичного рівня, забезпечує постійну валентність водню, що дорівнює 1. В більшості випадків цей електрон залишає простір атома і переходить у володіння більш электроотрицательных елементів. Лише реакції з металами дозволяють водню притягти у сферу впливу власного ядра електрон від активних атомів лужних або лужноземельних елементів, утворюючи білі кристалічні сполуки – їх гідриди.
Активний і агресивний
Атомарний водень, так би мовити, легкий на підйом. Його швидкості відновлення металів з їх оксидів можуть позаздрити інші відновники начебто вуглецю або його оксидів. Так само активно атоми H з’єднуються з частинками сірки, кисню, фосфору. А полум’я пальника з атомарним воднем дає розігрів вище 4000 °C. З цієї причини такими приладами легко обробляти поверхні металів: різати або зварювати їх.

Атомарний водень добре зарекомендував себе в якості відновника чистих металів – вольфраму, молібдену – із їх руд, представлених, в основному, оксидами. Зустрічаючись з такими ж атомами, як і він сам, водень утворює стійку і пасивну структуру – молекулу. Обидва атома H тримаються один за одного за допомогою спільної електронної пари, будучи зразком стабільної ковалентного неполярного зв’язку. Вона міцна і забезпечує стійкість молекул H2 як в умовах земного існування, так і на просторах космосу. Не обійшлася без водню і харчова промисловість, у якої його застосовують для гідрогенізації олій та отримання модних у сучасній дієтології низькокалорійних спредів.

У нашій статті ми розглянули, як будова атома водню, і з’ясували, як воно впливає на властивості простої речовини








