Калієва сіль хлорноватої кислоти, або хлорат калію, являє собою неорганічні з’єднання, що володіє вибуховими властивостями. Висока чутливість до тертя і реакційна здатність обмежують область його застосування в промисловості.
Загальний опис
Хлорат калію – тверда речовина у вигляді дрібного кристалічного порошку білого кольору, не має запаху. Кристали мають пластинчастої, голчастої або призматичної форми. Інша назва цього з’єднання – бертолетова сіль. Воно присвоєно по імені французького хіміка Клода Луї Бертолле. Цей вчений вперше синтезував дана речовина в 1786 році за допомогою пропускання хлору через розчин калієвого лугу. Тоді ж були відкриті і його вибухові властивості.
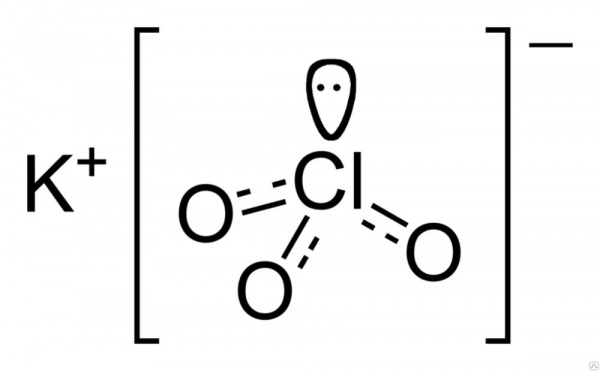
Емпірична формула хлорату калію має вигляд: ClKO₃.
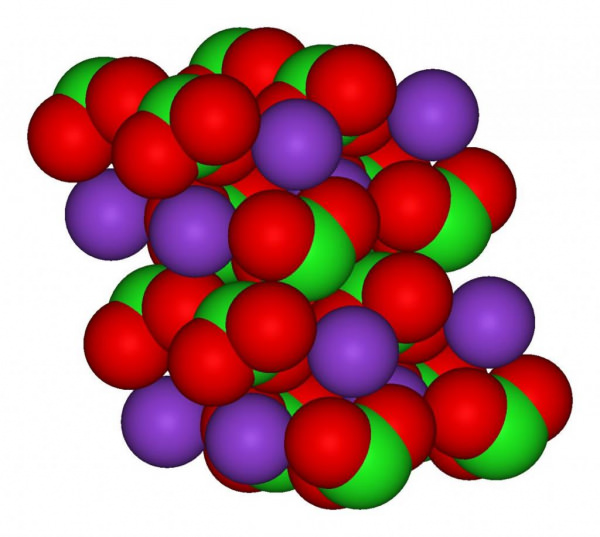
Структурно речовина представлено на малюнку нижче. Три атома кисню пов’язані з атомом хлору допомогою ковалентного зв’язку, а взаємодія атома калію і хлору носить іонний характер.
За хімічним складом компоненти розподіляються таким чином:
- К – 31,92 %;
- Cl – 28,92 %;
- Про – 39,16 %.
Хімічні властивості
Хлорат калію є сильним окислювачем. Це властивість використовувалося для отримання пороху. Дане з’єднання може «підпалити» багато речовини, тому при роботі з ним потрібно акуратність.

Дане з’єднання характеризується наступними основними хімічними властивостями:
Цікавою особливістю є те, що розкладання хлорату калію протікає з виділенням теплоти, а перхлорату – з поглинанням її. У перхлоратів також вище температура займання. Даний факт є перевагою у поводженні з ClKO₄.
Фізичні властивості
Якщо в порошку присутні домішки Mn, CuO, Fe2O3 Cr2O3 та інші оксиди, то температура розкладання сильно знижується (до 200 °C).
Основні фізичні властивості хлорату калію перераховані нижче:
- температура плавлення – 356 °C;
- температура кипіння – 400 °C;
- гравіметрична щільність – 2100-2250 кг/м3;
- кристалічна щільність – 2340 кг/м3;
- молярна маса – 122,594 г/моль;
- розчинність у воді – хороша (69,9 г /л при температурі 20 °C).
Отримання
У хімічній промисловості синтез хлорату калію проводиться за допомогою дисмутації солей хлорнуватистої кислоти HClO (реакція самоокислення-самовідновлення). Найбільш поширеним способом є обмін між Ca(ClO₃)₂ і KCl.
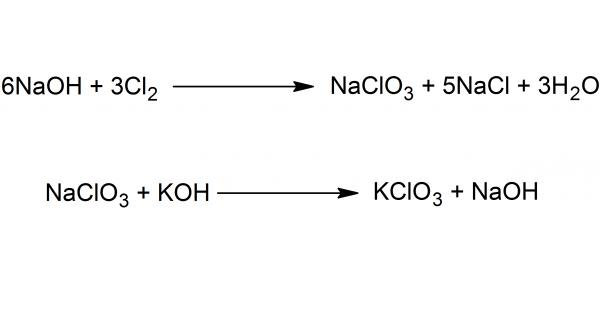
На малюнку нижче представлена схема отримання речовини в два етапи – пропусканням хлору через розчин їдкого натру з подальшим обмінною реакцією між хлоратом натрію і каустичним поташем.
Існують і інші методи – термічне розкладання гіпохлориту калію, електрохімічний метод (електроліз водних розчинів хлоридів).
Вплив на живі організми
Хлорат калію є токсичною речовиною. Отруєння цією сполукою призводить до появи наступних симптомів:
- при потраплянні в ШКТ: біль в епігастрії, нудота, блювання;
- при ураженні очей або шкіри: подразнення, почервоніння;
- при попаданні в органи дихання: кашель, болі, утруднене дихання.
Смертельна доза – 1г/кг Речовина токсична для флори і фауни природних водойм.
В якості першої допомоги потерпілому необхідно вжити наступні заходи:
- вивести на свіже повітря;
- промити шкіру (очі) чистою водою;
- прополоскати рот водою;
- зняти забруднений одяг.
Заходи безпеки
При зберіганні речовина необхідно берегти від джерел тепла і відкритого вогню. У приміщенні не можна палити. Не допускається змішувати з’єднання з горючими матеріалами, так як це може призвести до вибуху.
При займанні хлорату калію вогонь гасять піском, вуглекислотою у порошкових вогнегасниках. Якщо сталося загоряння великої кількості речовини, то необхідно залишити небезпечну зону.
Виготовлення вибухових речовин
В кінці XIX – початку XX століття хлорат калію використовувався в якості вибухової речовини. На його основі виготовляють так званий «порох Бертолле», склад якого включав 75 % бертолетової солі і по 12,5 % сірки і вугілля. На відміну від звичайного чорного пороху, зробленого з калієвої селітри, дана хімічна композиція має дуже високу чутливість до механічного впливу. Від тертя або удару порох Бертолле може зайнятися або вибухнути. І хоча по потужності він перевершував всі відомі види вибухових речовин в той час, хімічна нестійкість визначила його обмежене застосування. В Швейцарії для підвищення безпеки вибухових речовин, використовуваних при будівництві шахт, хлоратні з’єднання желатинировали.
Під час Першої світової війни хлорат калію використовувався в складі інших видів вибухових речовин. Так, в Німеччині успішно застосовувалася «сілезія» (80 % ClKO₃ і 20 % смоли, обробленої азотною кислотою). В Австрії такі склади включали ClKO₃ і антраценове масло. Поступово хлорат калію, як складовий елемент вибухових сумішей, був витіснений хлоратом натрію. У 1941-1945 рр. дане з’єднання входило в терочный складу німецьких ручних гранат.
Інші області застосування
В даний час хлорат калію іноді використовується в якості джерела хлору в піротехнічних складах для отримання кольорового вогню. Завдяки йому феєрверк горить інтенсивніше і не слабшає під тиском повітря. Тому дане з’єднання застосовують для ракет-форсов.

Бертолетова сіль є також у складі сірникових головок. Якщо зішкребти речовина, зібрати його у вигляді гірки на твердій основі і стукнути молотком, то можна спостерігати явище микровзрыва. Цей приклад наочно ілюструє виняткову чутливість і небезпека використання хлорату калію.
Дана речовина застосовувалося також деякий час як антисептичний засіб для полоскання рота і горла. Після того, як були виявлені його токсичні властивості, його перестали використовувати в медичних цілях.








